
| A. | Q1>Q2>Q3 | B. | Q1>Q3>Q2 | C. | Q3>Q2>Q1 | D. | Q2>Q1>Q3 |
分析 三个反应都为放热反应,物质发生化学反应时,生成液态水比生成气态水放出的热量多,反应越完全,放出的热量越多,以此解答该题.
解答 解:已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) Q1 kJ,
②2H2S(g)+O2(g)=2S (s)+2H2O(l) Q2 kJ,
③2H2S(g)+O2(g)=2S (s)+2H2O(g) Q3kJ,
①与②相比较,由于S→SO2放热,则Q1>Q2,
②与③相比较,由于H2O(l)→H2O(g)吸热,则Q2>Q3,
所以Q1、Q2、Q3三者关系为:Q1>Q2>Q3,
故选A.
点评 本题考查反应热与焓变的应用,题目难度中等,本题注意从物质反应的程度以及物质的聚集状态的角度比较反应热的大小,试题培养了学生的分析能力及灵活应用能力.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,1 L 0.50 mol•L-1 NH4Cl溶液与2 L 0.25 mol•L-1 NH4Cl溶液含NH+4物质的量不同 | |
| B. | 1L1mol/L的盐酸溶液中,所含氯化氢分子数为NA | |
| C. | 在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移4NA个电子 | |
| D. | 乙烯和环丙烷(C3H6)组成的28g混合气体中含有3NA个氢原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁溶液与足量的烧碱溶液反应 2OH-+Mg2++2HCO3-=MgCO3↓+CO32-+2H2Of | |
| B. | 氯化铵溶液与澄清石灰水反应 NH4++OH-=NH3↑+H2O7 | |
| C. | 碘化亚铁与溴水反应 2I-+Br2=I2+2Br- | |
| D. | 向偏铝酸钠溶液中加入少量的NaHSO4溶液 AlO2-+H++H2O═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏完毕后,先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置 | |
| B. | 向容量瓶转移液体时,引流的玻璃棒可以接触容量瓶内壁 | |
| C. | 将Cl2和HCl通入饱和食盐水可以得到纯净的Cl2 | |
| D. | 用排水集气法收集铜粉与稀硝酸反应产生的NO |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
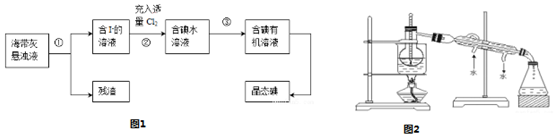
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4溶液和MgCl2溶液 | B. | Na2CO3溶液和稀硫酸 | ||
| C. | NaOH溶液和Fe(SO4)3溶液 | D. | Ca(OH)2溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
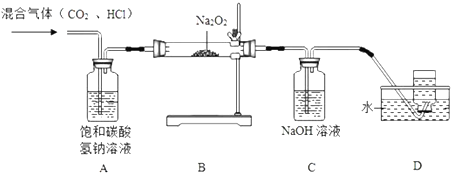
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com