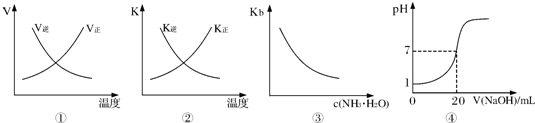
分析:A、该反应为吸热反应,升高温度后,正逆反应速率都增大,而图象中达到平衡后升高温度,逆反应速率减小是错误的;
B、对应放热反应,达到平衡后温度升高,平衡向着逆向移动,逆反应的平衡常数应该增大,正反应平衡常数减小,图象与实际反应不相符;
C、电离平衡常数只与温度有关,温度不变,平衡常数不变,图象与图象中平衡常数随着浓度的增大而增大是错误的;
D、0.lmol?L-1盐酸的pH为1,二者都是一元强酸、强碱,浓度相同,所以当加入20mL氢氧化钠时恰好反应.
解答:解:A、该反应为吸热反应,温度升高,正逆反应速率都增大,平衡向着正向移动,所以正反应速率大于逆反应速率,而图象中达到平衡后升高温度,逆反应速率减小是错误的,逆反应速率也应该增大,故A错误;
B、该反应为放热反应,升高温度后平衡向着逆向移动,所以逆反应的平衡常数增大,正反应的平衡常数减小,而图象中达到平衡后升高温度,逆反应的平衡常数减小、正反应的平衡常数增大与实际不相符,故B错误;
C、氨水的电离平衡常数与浓度没有关系,只受温度的影响,所以温度不变,电离平衡常数不变,而图象中平衡常数随着氨水的浓度增大而减小是错误的,故C错误;
D、25℃时,用0.1mol?L-1NaOH溶液滴定20mL 0.lmol?L-1盐酸,滴定前盐酸的pH=1,随着氢氧化钠体积不断增大,溶液的pH逐渐增大,当加入20mL氢氧化钠溶液时,二者恰好反应,溶液的pH=7,该图象符合反应实际,故D正确;
故选D.
点评:本题考查图象分析,涉及铝化合物性质、碳酸盐性质、中和滴定、可逆反应等,难度中等,清楚反应过程与可逆反应的特点是关键,注意图象中量的关系.