
(13分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。

请回答下列问题:
(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
:(1)四 ⅦA(各1分,共2分)(2)产生苍白色火焰(2分)(3)2∶1(3分)
(4)3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓(3分)
(5)4Fe(NO3)3 2Fe2O3+ 12NO2↑+ 3O2↑(3分)
2Fe2O3+ 12NO2↑+ 3O2↑(3分)
【解析】:根据题中的已知条件,F是地壳中含量最多的金属元素的单质,则F为Al,I为红棕色气体,则I为NO2,M为红褐色沉淀,则M为Fe(OH)3。结合框图,C为NaOH,A、B为气态单质,A为H2、B为Cl2,X为NaCl,E为黑色固体,则E为MnO2,D为HCl,G为NaAlO2,N为HNO3,Y为Fe(NO3)3,H为Fe2O3,J为FeCl3。
(1)B中所含元素为Cl,处于周期表中第四周期第ⅦA。
(2)H2在Cl2中燃烧的现象为气体安静燃烧,火焰呈苍白色,并白雾产生。
(3)由MnO2 + 4HCl(浓) MnCl2
+ H2O + Cl2↑可知,被氧化的是HCl(浓),物质的量为2mol,被还原的物质是MnO2,物质的量为1mol,物质的量之比为2∶1。
MnCl2
+ H2O + Cl2↑可知,被氧化的是HCl(浓),物质的量为2mol,被还原的物质是MnO2,物质的量为1mol,物质的量之比为2∶1。
(4)NaAlO2和FeCl3在溶液中发生双水解,离子方程式为3AlO2-+Fe3++6H2O=3Al(OH)3↓+Fe(OH)3↓
(5)Fe(NO3)3受热分解的方程式为4Fe(NO3)3 2Fe2O3+ 12NO2↑+ 3O2↑
2Fe2O3+ 12NO2↑+ 3O2↑
考点定位:本题考查无机推断,涉及到金属元素Na、Al、Fe、Mn和非金属元素H、O、N、Cl。


科目:高中化学 来源: 题型:

图6-13
(1)根据上图模型写出萨罗的结构简式:__________。
(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸)。请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)。
(3)同时符合下列四个要求的水杨酸的同分异构体共有__________种。
①含有苯环;
②能发生银镜反应,不能发生水解反应;
③在稀NaOH溶液中,1 mol该同分异构体能与2 mol NaOH发生反应;
④只能生成两种一氯代产物。
(4)从(3)确定的同分异构体中任选一种,指定为下列框图中的A。

写出下列两个反应的化学方程式(有机物用结构简式表示),并指出相应的反应类型。
①A![]() B____________________________。
B____________________________。
反应类型:____________________________。
②B+D![]() E_________________________。
E_________________________。
反应类型:____________________________。
(5)现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol。该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积)。
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示)。
②设混合物中水杨酸的物质的量为x mol,列出x的计算式。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(四川卷带解析) 题型:填空题
(13分)下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
请回答下列问题:
(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年三校上海市)高三联考化学试卷(解析版) 题型:填空题
(本题共8分)
水煤气法制甲醇工艺流程框图如下

(注:除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成)
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为
;
②下列能提高碳的平衡转化率的措施是 。
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为:
CH4
(g)+3/2O2 (g) CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
① X在T1℃时催化效率最高,能使正反应速率加快约3×105倍;
② Y在T2℃时催化效率最高,能使正反应速率加快约3×105倍;
③ Z在T3℃时催化效率最高,能使逆反应速率加快约1×106倍;
已知:T1>T2>T3,根据上述信息,你认为在生产中应该选择的适宜催化剂是 (填“X”或“Y”或“Z”),选择的理由是 。
(3)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,主要反应是:2H2(g) + CO(g)  CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
CH3OH(g)+181.6kJ。T4℃下此反应的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组分的浓度如下:
|
物质 |
H2 |
CO |
CH3OH |
|
浓度/(mol·L-1) |
0.2 |
0.1 |
0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入同样多的CO、H2,在T5℃反应,10 min后达到平衡,此时c(H2)=0.4 mol·L-1、c(CO)=0.7 mol·L-1、则该时间内反应速率v(CH3OH) = mol·(L·min)-1。
(4)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
水煤气法制甲醇工艺流程框图如下
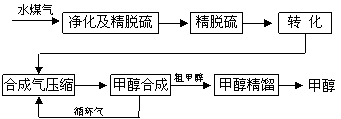 |
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;(填字母代号)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,
主要反应如下: 2H2(g) + CO(g) ![]() CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组
分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com