
下列关于胶体的说法中,正确的是( )
A.胶体与溶液有明显不同的外观特征,胶体呈胶状
B.胶体不稳定,静止后容易产生沉淀
C.将Fe(OH)3胶体进行过滤,所得到的滤液与原来胶体的组成是不同的
D.豆浆是胶体,因为豆浆中的分散质微粒直径在1~100 nm之间
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
在一个不导热的密闭反应器中,只发生两个反应:
a(g)+b(g)2c(g) Δ H1<0
H1<0
x(g)+3y(g)2z(g) ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入惰性气体,c的物质的量不变
B.等压时,通入z气体,反应器中温度升高
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入z气体,y的物质的量浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸是强酸,中学阶段将硫酸在水溶液中看做完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为H2SO4===H++HSO ,HSO
,HSO H++SO
H++SO 。
。
请回答下列有关问题:
(1)Na2SO4溶液 呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
呈________(填“弱酸性”、“中性”或“弱碱性”),其理由是
_____________________________________________________________。
(用离子方程式表示)。
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为________
________________________________________________________________________。
(3)在0.10 mol·L-1的Na2SO4溶液中,下列离子浓度的关系正确的是________(填写编号)。
A.c(Na+)=c(SO )+c(HSO
)+c(HSO )+c(H2SO4)
)+c(H2SO4)
B.c(OH-)=c(HSO )+c(H+)
)+c(H+)
C.c(Na+)+c(H+)=c(OH-)+c(HSO )+2c(SO
)+2c(SO )
)
D.c(Na+)=2c(SO )+2c(HSO
)+2c(HSO )
)
(4)若25℃时,0.10 mol·L-1的NaHSO4溶液中c(SO )=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO
)=0.029 mol·L -1,则0.10 mol·L-1的H2SO4溶液中c(SO )________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
)________0.029 mol·L-1(填“<”、“>”或“=”),其理由是
________________________________________________________________________
________________________________________________________________________。
(5)或25℃时,0.10 mol·L-1H2SO4溶液的pH=-lg 0.11,则0.10 mol·L-1H2SO4溶液中c(SO )=________ mol·L-1。
)=________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
现拟分离乙酸乙酯、乙酸和乙醇的混合物,下图是分离操作步骤流程图。请写出图中圆括号内适当的试剂,方括号内所用的分离方法,方框内所分离的有关物质的化学式。
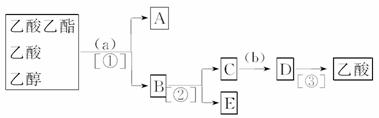
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关H2SO4的电离方程式,正确的是( )
A.H2SO4===H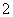 +SO
+SO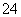 B.H2SO4===2H++S
B.H2SO4===2H++S 4
4
C.H2SO4===2H++S6++4O2- D.H2SO4===2H++SO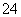
查看答案和解析>>
科目:高中化学 来源: 题型:
已知溶液中存在下列离子,试判断该溶液的溶质并写出其电离方程式:
(1)H+、Cl-__________________________________________。
(2)Fe3+、SO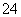 _____________________________________________。
_____________________________________________。
(3)Na+、HCO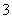 __________________________________________________。
__________________________________________________。
(4)NH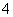 、NO
、NO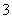 _______________________________________________。
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示,已知 Ksp(CaSO4)=9×10-6。下列说法正确的是( )
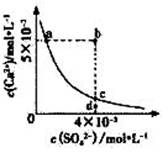
A.a点对应的KSP小于c点对应的KSP B.a点变为b点将有沉淀生成
C.加入蒸馏水可以使c点变为d点 D.含有大量SO42-的溶液中肯定不存在Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
金属冶炼与处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是________。[来源:Z#xx#k.Com]
a.Fe2O3 b.NaCl
c.Cu2S d.Al2O3[来源:学,科,网Z,X,X,K]
(2)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________。当1 mol O2发生反应时,还原剂所失电子的物质的量为________mol。向CuSO4溶液中加入镁条时有气体生成,该气体是________。
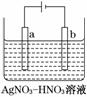
(3)右图为电解精炼银的示意图,________(填“a”或“b”)极为含有杂质的粗银,若b极有少量红棕色气体产生,则生成该气体的电极反应式为__________________________。
(4)为处理银器表面的黑斑(Ag2S),将银器浸于铝质容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用是______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com