
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
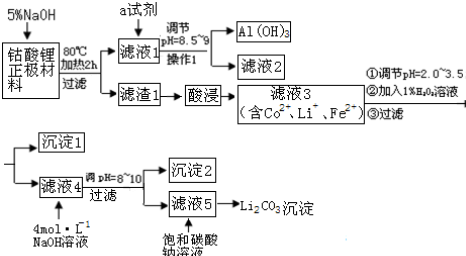
分析 废旧锂离子电池正极正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)用氢氧化钠溶液碱溶,铝箔参加反应,过滤得到滤液1偏铝酸钠溶液,调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入酸,过氧化氢调节溶液PH过滤得到滤液含二价钴离子和锂离子,沉淀1是氢氧化铁,向滤液4中加氢氧化钠调节PH得到沉淀2,沉淀2为氢氧化钴沉淀,滤液5中含锂离子,加入饱和碳酸钠溶液沉淀锂离子得到碳酸锂沉淀,
(1)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气;
(2)操作1为过滤,根据过滤实验选择;
(3)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液浓度越高,或溶剂的蒸发速度越快,或溶液冷却越快,析出的晶粒就越小;
(4)盐酸在反应中的化合价升高,失电子作还原剂,在产物中生成了氯化物,体现了盐酸的酸性;根据所加入的反应物以及生成物结合守恒定律来书写化学方程式;根据环境保护和操作的便利性提出建议;
(5)偏铝酸根与碳酸氢根反应产生氢氧化铝;
(6)根据分析可知沉淀2是氢氧化钴.
解答 解:废旧锂离子电池正极正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)用氢氧化钠溶液碱溶,铝箔参加反应,过滤得到滤液1偏铝酸钠溶液,调节溶液PH过滤得到氢氧化铝沉淀;滤渣加入酸,过氧化氢调节溶液PH过滤得到滤液含二价钴离子和锂离子,沉淀1是氢氧化铁,向滤液4中加氢氧化钠调节PH得到沉淀2,沉淀2为氢氧化钴沉淀,滤液5中含锂离子,加入饱和碳酸钠溶液沉淀锂离子得到碳酸锂沉淀.
(1)碱浸正极时,铝和氢氧根离子反应生成偏铝酸根离子和氢气,离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)操作1为过滤,所用到的玻璃仪器除烧杯、漏斗外,还需要玻璃棒,
故答案为:玻璃棒;
(3)晶体颗粒的大小与结晶条件有关,溶质的溶解度越小,或溶液浓度越高,或溶剂的蒸发速度越快,或溶液冷却越快,析出的晶粒就越小;反之,可得到较大的晶体颗粒,故答案为:AC;
(4)盐酸在反应中的化合价升高,失电子作还原剂,盐酸体现了还原性,在产物中生成了氯化物,体现了盐酸的酸性;钴的化合价从+3降到+2,双氧水中的氧从-1升高到0,1个双氧水升高2价,则LiCoO2与H2O2之比为2:1,配平离子方程式为:2LiCoO2+6H++H2O2=2 Co2++O2↑+2Li++4H2O;根据环境保护和操作的便利性提出建议为:用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦,
故答案为:酸性和还原性;2;6H+;1;2;1;2;4H2O;用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦;
(5)滤液1偏铝酸钠溶液,偏铝酸根与碳酸氢根反应产生氢氧化铝,所以选碳酸氢钠,
故答案为:C;
(6)向滤液4中加氢氧化钠调节PH为8到10,二价钴离子全部沉淀,则沉淀2为氢氧化钴,
故答案为:Co(OH)2.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
 ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaCl | MgCl2 | AlCl3 | SiCl4 | |
| 熔点(℃) | 801 | 714 | 190 | -70 |
| 沸点(℃) | 1413 | 1412 | 180 | 57.57 |
| A. | ①② | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CO32-)>c(HCO3-) | |
| B. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| C. | c(Na+)>c(HCO3-)>c(H+)>c(OH-) | |
| D. | c(HCO3-)+2c(CO32-)+c(H2CO3)=1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
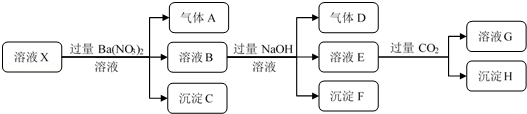
| A. | 根据上述连续实验不能确定溶液X中是否含有Fe3+ | |
| B. | 沉淀H为Al(OH)3 | |
| C. | 溶液中一定含有H+、Al3+、NH4+、Fe2+、SO42-、Cl- | |
| D. | 若溶液X为100 mL,产生的气体A为112 mL(标况),则X中c(Fe2+)=0.15 mol•L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com