
| ||
| ||


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:阅读理解
| 实验方法 | 实验现象 | 结论 |
| 分别向A、B溶液中加KSCN溶液 | 溶液变红色 溶液变红色 |
固体物质中FeCl3 |
| 分别向KMnO4溶液中加入适量A、B溶液 | KMnO4溶液颜色无明显变化 | 固体物质中不含 FeCl2 FeCl2 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
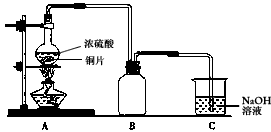
为了探究铜与浓硫酸的反应,某研究性学习小组做了如下实验:
①在放有铜片的圆底烧瓶中加入10 mL浓硫酸,加热煮沸10 min(如上图所示)后,所得固体分离除去未反应的铜片,再经水洗仍有大量黑色不溶物。
②取少量不溶物,向其中加入几滴浓硝酸,产生大量红棕色气体。
③取少量不溶物,向其中加5 mL酒精,充分振荡后,静置、过滤,把滤液移入盛有水的小试管中,振荡,出现浑浊。
④取少量不溶物,向其中加入3 mL氨水,振荡,溶液呈无色,在空气中静置,溶液变为深蓝色。
⑤取少量不溶物,向其中加入浓盐酸并加热,沉淀几乎全部溶解。
为了解释上述现象,学习小组通过查阅资料了解到:
| a.铜与浓硫酸反应的不溶性副产物可能有:CuS、Cu2S、Cu2O、S等物质; b.CuS和Cu2S都能溶于热的浓盐酸; c.Cu2O能溶于氨水生成无色的[Cu(NH3)2]+, [Cu(NH3)2]+在氨水中被空气中的氧气氧化成深蓝色的[Cu(NH3)4]2+。 |
回答下列问题:
(1)第②步操作要注意的问题是____________ ;对比①②两步操作中的现象,你能得到的结论是____________ 。
(2)第③步操作中出现的沉淀是____________ ,请解释出现这一现象的原因____________ 。
(3)写出④步涉及的离子方程式____________ 。
(4)综合分析铜与浓硫酸的反应,生成的不溶物是____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年浙江省杭州市高三第二次月考化学试卷(解析版) 题型:选择题
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙。过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论不正确的是
A.铜与浓硫酸反应所得白色固体甲是CuSO4
B.加BaCl2溶液后所得白色沉淀是BaSO3
C.白色固体甲中夹杂的少量黑色物质乙中可能含有CuO
D.白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S
查看答案和解析>>
科目:高中化学 来源:河北省模拟题 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com