
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
分析 2.24L(标况下)CO2气体的物质的量为0.1mol,二氧化碳完全反应,
若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g;
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物,
设白色固体中K2CO3 x mol,KHCO3 y mol,根据C元素守恒及二者质量列方程计算,再根据钾离子守恒计算KOH物质的量,根据c=$\frac{n}{V}$计算KOH溶液物质的量浓度.
解答 解:2.24L(标况下)CO2气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,
若只发生:CO2+2KOH=K2CO3+H2O,则生成0.1mol的K2CO3,其质量=0.1mol×138g/mol=13.8g,
若只发生:CO2+KOH=KHCO3,则生成0.1mol的KHCO3,其质量=0.1mol×100g/mol=10g,
由于13.8g>11.9g>10.0g,所以得到的白色固体是K2CO3和KHCO3的混合物;
设白色固体中K2CO3 x mol,KHCO3 y mol,
根据碳原子守恒,有:x mol+y mol=0.1 mol,
由二者质量可知:138g•mol-1×x mol+100 g•mol-1×y mol=11.9g
联立方程,解得x=0.05mol y=0.05mol
故白色固体中含有K2CO3 的质量=138g•mol-1×0.05 mol=6.9g,
原溶液中KOH物质的量为 2xmol+ymol=2×0.05mol+0.05mol=0.15mol,所用KOH溶液物质的量浓度为$\frac{0.15mol}{0.3L}$=0.500 mol•L-1,
综上分析可知,ABC正确、D错误,
故选D.
点评 本题考查混合物的计算,题目难度中等,利用极限法判断产物的组成是解题关键.


科目:高中化学 来源: 题型:解答题
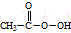 (过氧乙酸)+H2O
(过氧乙酸)+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
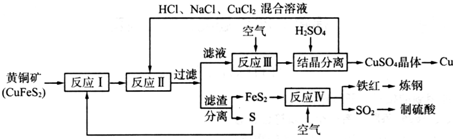
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:
已知A、B、C、D、E、F都是周期表中前四周期的元素,且原子序数依次增大.A元素的阳离子核外无电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,C与B同周期,核外有三个未成对电子;D元素的基态原子核外有8种运动状态的电子;E元素的最高正价与最低负价的代数和为4;F元素的正三价离子的3d轨道为半充满;请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  观察Fe(OH)2的生成 | B. |  配制一定量浓度的NaNO3的溶液 | ||
| C. | 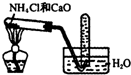 实验室制取氨气 | D. |  验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的弱 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
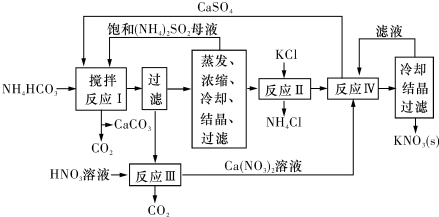
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓烧碱溶液中加入铝片:A1+2OH-+2H2O═[A1(OH)4]-+H2↑ | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3一═CaCO3↓+H2O | |
| C. | 食醋和小苏打溶液混合;CH3COOH+HCO3一═CH3COO-十H2O+CO2↑ | |
| D. | 敞开体系,向FeC12溶液滴加NaOH溶液:4Fe2++8OH-+O2+2H2O═4Fe (OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新型材料聚酯纤维、光导纤维都属于有机高分子 | |
| B. | 14C可用于文物年代的鉴定,14C与12C互为同素异形体 | |
| C. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| D. | “开发利用新能源”、“汽车尾气催化净化”都能提高空气质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com