
【题目】下列离子方程式正确的是
A. 等物质的量的NO和NO2同时被NaOH溶液吸收:NO + NO2 +2OH-= 2NO2-+H2O
B. 等物质的量的MgCl2、Ba(OH)2和 HCl 溶液混合:Mg2++3OH﹣+H+=Mg(OH)2↓+H2O
C. 铅蓄电池充电时的阴极反应:PbSO4+2H2O﹣2e﹣=PbO2+4H++SO42﹣
D. 以金属银为阳极电解饱和NaCl溶液:2Cl﹣+2H2O![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
【答案】A
【解析】A. 等物质的量的NO和NO2同时被NaOH溶液吸收,NO和NO2发生氧化还原反应生成NO2-,离子方程式为:NO + NO2 +2OH-= 2NO2-+H2O,故A正确; B. 等物质的量的MgCl2、Ba(OH)2和 HCl 溶液混合后首先发生中和反应,剩余的氢氧化钡再与氯化镁反应生成氢氧化镁沉淀,离子方程式为:Mg2++2H++4OH-=Mg(OH)2↓+2H2O,故B错误;C. 铅蓄电池充电时的阴极反应为PbSO4得电子生成Pb和SO42﹣,电极反应式为:PbSO4+2e﹣=Pb+SO42﹣,故C错误;D. 以金属银为阳极电解饱和NaCl溶液,银在阳极上失电子,反应的离子方程式为:2Ag+2H2O![]() H2↑+2AgOH,故D错误;答案选A。
H2↑+2AgOH,故D错误;答案选A。


科目:高中化学 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人体重要的能源物质,请根据它们的性质回答以下问题:
(1)油脂在酸性和碱性条件下水解的共同产物是(写名称).
(2)蛋白质的水解产物具有的官能团是(写结构简式).
(3)已知A是人体能消化的一种天然高分子化合物,B和C分别是A在不同条件下的水解产物,它们有如下转化关系。
①下列说法不正确的是:
A、1molC完全水解可生成2molB
B、工业上常利用反应⑦给热水瓶胆镀银
C、用A进行酿酒的过程就是A的水解反应过程
D、A的水溶液可以发生丁达尔效应
E、反应③属于吸热反应
②请设计实验证明A通过反应①已经全部水解,写出操作方法、现象和结论
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I、甲醇可以补充和部分替代石油燃料,缓解能源紧张。利用CO可以合成甲醇。
(1) 已知:CO(g)+1/2O2(g)=CO2(g) △H1=-283.0kJ·mol-1
H2(g)+1/2O2(g)=H2O(l) △H2=-285.8kJ·mol-1
CH3OH(g)+3/2 O2(g)=CO2(g)+2H2O(l) △H3=-764.5kJ·mol-1
则CO(g)+2H2(g)=CH3OH(g) △H=____________kJ·mol-1
(2)一定条件下,在容积为2L的密闭容器中充入1mol CO与2 mol H2合成甲醇 平衡转化率与温度、压强的关系如右图所示。

①在2 min时测得容器内甲醇的浓度为0.25 mol·L-1,则0-2 min内CO的平均反应速率为____mol·L-1·min-1,H2的转化率为____。
②由图判断P1_______P2(填“>” 、“<” 或“=” ),理由是____________________________________
③该甲醇合成反应在A点的平衡常数K=____
④下列措施中能够同时满足增大反应速率和提高CO转化率的是____。(填写相 应字母)
A、使用高效催化剂 b、降低反应温度 c、增大体系压强
D、不断将CH3OH从反应混合物中分离出来
Ⅱ、某学习小组以SO2为原料,采用电化学方法制取硫酸。
(3)原电池法:
该小组设计的原电池原理如右图所示。

该电池中右侧为________极,写出该电池负极的电极反应式 ____。
(4)电解法:
该小组用Na2SO3溶液充分吸收SO2得到NaHSO3溶液,然后电解该溶液制得了硫酸。原理如右图所示。

写出开始电解时阳极的电极反应式____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列物质进行的分类正确的是( )
A.纯碱、烧碱都属于碱B.CuSO4·5H2O属于电解质
C.凡能电离出H+的化合物都属于酸D.盐类物质一定含有金属阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、 氮、磷、砷和硼的相关化合物在化工、医药、农药、材料等领域有着广泛的应用。锂、钠、铝、铁等金属在日常生活、工业生产中也占有举足轻重的地位,请回答下列问题:
(1)基态As原子的电子排布式为[Ar]______________________;
(2)氮化硼(BN)有多种晶型,其中立方氮化硼与金刚石的构型类似,则其晶胞中B—N—B之间的夹角是___________________(填角度)。
(3)砷化硼(BAs)是ⅢA一VA族半导体材料的重要成员之一,其晶体结构与金刚石相似。
①BAs晶体中,每个As与____________个B相连,As的杂化形式为_______________;
②已知B原子的电负性比As原子的电负性大,则As与B之间存在的化学键有____________(填字母)。
A.离子键 B.金属键 C.极性键 D.氢键 E.配位键 F.σ键 G.π键
(4)铁的另一种配合物Fe(CO)5熔点为-20.5℃,沸点为103℃,易溶于CCl4,据此可以判断Fe(CO)5晶体属于________________________________(填晶体类型)。
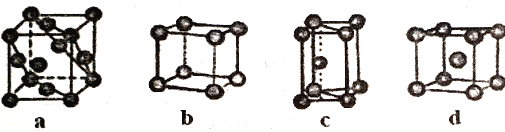
(5)金属晶体的四种堆积如下图,金属钠的晶体堆积模型为___________(填字母)。
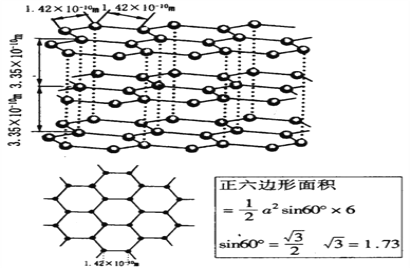
(6)石墨晶体的结构如下图,石墨的密度为________________________________(只列式不化简不计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.按系统命名法,化合物 ![]() (键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
(键线式结构)的名称是2,3,5,5﹣四甲基﹣4,4﹣二乙基己烷
B.环己烯与化合物  (键线式结构)互为同系物
(键线式结构)互为同系物
C.分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种
D.等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( ) 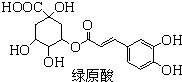
A.奎尼酸分子式为C9H8O4
B.1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH,1mol绿原酸与Br2水反应,最多消耗6mol Br2
C.绿原酸能发生取代、加成、消去和还原反应
D.咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1,2二氯乙烷常温下为无色液体,沸点83.5℃,密度1.23g/mL,难溶于水,易溶于醇、醚、丙酮等有机溶剂.乙醇的沸点为78.5℃.某化学课外活动小组为探究1,2二氯乙烷的消去反应,设计了如下实验装置.请回答下列问题. 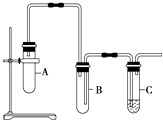
(1)请回答如何检查装置气密性
(2)向装置A中大试管里先加入1,2二氯乙烷和NaOH的乙醇溶液,再加入碎瓷片,目的是 , 并向装置C中试管里加入适量稀溴水.
(3)为了使反应在75℃左右进行,常用的方法是 .
(4)与装置A中大试管相连接的长玻璃管的作用是 , 装置B的作用是 .
(5)证明1,2二氯乙烷已发生消去反应的现象是 , 装置A、C中发生反应的化学方程式为装置A; 装置C .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com