
”¾ĢāÄæ”æŅŅĖįÕż¶”õ„(CH3CH2CH2CH2OOCCH3)ŹĒŅ»ÖÖÓÅĮ¼µÄÓŠ»śČܼĮ”£ŹµŃéŹŅÖʱøÉŁĮæŅŅĖįÕż¶”õ„µÄ·“Ó¦ĪŖCH3COOH+CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OOCCH3+H2O”£
CH3CH2CH2CH2OOCCH3+H2Oӣ
ŹµŃé²½ÖčČēĻĀ£ŗ
²½Öč1£ŗĻņŅĒĘ÷AÖŠ¼ÓČė11.5 mLÕż¶”“¼(Ī¢ČÜÓŚĖ®)”¢1 mLÅØH2SO4”¢7.2 mL±ł“×Ėį¼°·ŠŹÆÉŁŠķ”£
²½Öč2£ŗ°“ČēĶ¼Į¬½Ó×°ÖĆ”£
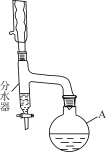
²½Öč3£ŗĻņ·ÖĖ®Ę÷ÖŠŌ¤ĻČ¼ÓÉŁĮæĖ®(ĀŌµĶÓŚÖ§¹ÜæŚ)”£ĶØČėĄäČ“Ė®£¬¼ÓČČ»ŲĮ÷”£
²½Öč4£ŗ½«·ÖĖ®Ę÷·Ö³öµÄõ„²ćŗĶ·“Ó¦ŅŗŗĻ²¢×ŖČė·ÖŅŗĀ©¶·ÖŠ£¬ŅĄ“ĪÓĆ5% Na2CO3ČÜŅŗ”¢Ė®Ļ“µÓ£¬·ÖĄė³öÓŠ»śĻą”£
²½Öč5£ŗ½«ÓŠ»śĻąÓĆĪŽĖ®ĮņĖįĆ¾øÉŌļ”¢¹żĀĖ”¢ÕōĮó£¬ŹÕ¼ÆŅŅĖįÕż¶”õ„”£
(1)ŅĒĘ÷AµÄĆū³ĘŹĒ________£»ĻņĘäÖŠ¼ÓČėĖé“ÉʬµÄÄæµÄŹĒ________”£
(2)×°ÖĆÖŠ·ÖĖ®Ę÷µÄ×÷ÓĆŹĒ________£¬ÅŠ¶Ļ·“Ó¦ŅŃ¾Ķź³ÉµÄ±źÖ¾ŹĒ________”£
(3)·“Ó¦Ź±Éś³ÉµÄÖ÷ŅŖÓŠ»śø±²śĪļÓŠ¶”ĆŃŗĶ________(ÓĆ½į¹¹¼ņŹ½±ķŹ¾)”£
(4)²½Öč4ÖŠ£¬·ÖĄė³öÓŠ»śĻąµÄ¾ßĢå²Ł×÷ŹĒ___________________”£
”¾“š°ø”æŌ²µ×ÉÕĘæ ·ĄÖ¹±©·Š ·ÖĄė³öõ„»Æ·“Ӧɜ³ÉµÄĖ®Ķ¬Ź±õ„²ćÖŠÕż¶”“¼»ŲĮ÷ÖĮÉÕĘæÖŠ¼ĢŠų·“Ó¦ Ė®²ćøß¶Č²»ŌŁ±ä»Æ CH3CH2CH=CH2 ĻČ·Å³öĻĀ²ćµÄĖ®²ć£¬ŌŁ½«ÓŠ»ś²ć“ÓÉĻæŚµ¹ČėŅ»øöøÉŌļµÄÉÕ±ÖŠ
”¾½āĪö”æ
(1)øł¾ŻŅĒĘ÷½į¹¹ÅŠ¶ĻŅĒĘ÷Ćū³Ę£»ŅŗĢå»ģŗĻĪļ¼ÓČČŹ±¼ÓČėĖé“ÉʬæÉ·ĄÖ¹±©·Š£»
(2)½įŗĻ²śÉśµÄĪļÖŹ¼°Õż¶”“¼µÄ·ŠµćµĶ£¬Ņ×»Ó·¢½ųČė·ÖĖ®Ę÷£¬ĒŅ²»Ņ×ČÜÓŚĖ®·ÖĪö£»
(3)½įŗĻ“¼µÄ»ÆѧŠŌÖŹÓė·“Ó¦ĪĀ¶ČµÄ¹ŲĻµ·ÖĪöÅŠ¶Ļ£»
(4)øł¾Żõ„µÄĆܶȱČĖ®Š”£¬ÄŃČÜÓŚĖ®·ÖĪö”£
(1)øł¾ŻĶ¼Ź¾æÉÖŖŅĒĘ÷AŹĒŌ²µ×ÉÕĘ棻ĻņĘäÖŠ¼ÓČėĖé“ÉʬµÄÄæµÄŹĒ·ĄÖ¹²śÉś±©·ŠĻÖĻó£»
(2)ŅŅĖįÓėÕż¶”“¼ŌŚÅØĮņĖį“ęŌŚŹ±£¬ŌŚ¼ÓČČĢõ¼žĻĀ·¢Éśõ„»Æ·“Ó¦²śÉśŅŅĖįÕż¶”õ„ŗĶĖ®£¬ÓÉÓŚÕż¶”“¼·Šµć±Č½ĻµĶ£¬Ņ×»Ó·¢£¬ĒŅŌŚĖ®ÖŠĪ¢ČÜ£¬·“Ӧɜ³ÉµÄõ„¼°Ė®ŗĶ»Ó·¢µÄĪ“·“Ó¦µÄ“¼½ųČė·ÖĖ®Ę÷£¬·ÖĖ®Ę÷ŌŚÄÜ·ÖĄė³öõ„»Æ·“Ӧɜ³ÉµÄĖ®µÄĶ¬Ź±£¬»¹æÉŅŌŹ¹õ„²ćÖŠÕż¶”“¼»ŲĮ÷ÖĮÉÕĘæÖŠ¼ĢŠų·“Ó¦£¬æÉĢįøßŌĮĻĄūÓĆĀŹ£»
Čō·“Ó¦ĶźČ«£¬Ōņ²»ŌŁÓŠÕż¶”“¼»Ó·¢½ųŠŠ·ÖĖ®Ę÷ÖŠ£¬·ÖĖ®Ę÷ÖŠŅŗĆę²»Éżøߣ¬“ĖŹ±ĖµĆ÷·“Ó¦“ļµ½ÖÕµć£»
(3)ŌŚ¼ÓČČŹ±·“Ó¦Ź±£¬æÉÄÜÓŠ²æ·ÖÕż¶”“¼·Ö×ÓÖ®¼äĶŃĖ®ŠĪ³Éø±²śĪļ¶”ĆŃ£»Čō¼ÓČČĪĀ¶Č¹żøߣ¬»¹»į·¢ÉśÕż¶”“¼·Ö×ÓÄŚĶŃĖ®Éś³É1-¶”Ļ©£ŗCH3CH2CH=CH2£»¹ŹøĆ·“Ó¦µÄÓŠ»śø±²śĪļÓŠ¶”ĆŃŗĶCH3CH2CH=CH2£»
(4)·“Ó¦²śÉśµÄŅŅĖįÕż¶”õ„ŹĒÄŃČÜÓŚĖ®£¬ĆܶȱČĖ®Š”µÄŅŗĢ壬·ÖĄė»„²»ĻąČܵÄĮ½²ćŅŗĢåĪļÖŹŹ¹ÓĆ·ÖŅŗ·½·Ø·ÖĄė£¬¼“½«»ģŗĻĪļĶعż·ÖŅŗĀ©¶·ĻĀæŚĻČ·Å³öĻĀ²ćµÄĖ®²ć£¬Č»ŗó¹Ų±Õ»īČū£¬ŌŁ½«ÓŠ»ś²ć“ÓÉĻæŚµ¹ČėŅ»øöøÉŌļµÄÉÕ±ÖŠ”£



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ¹ŲĻµĶ¼ÖŠ£¬AŹĒŅ»ÖÖÕżŃĪ£¬BŹĒĘųĢ¬Ēā»ÆĪļ£¬CŹĒµ„ÖŹ£¬FŹĒĒæĖį”£µ±XĪŽĀŪŹĒĒæĖį»¹ŹĒĒæ¼īŹ±¶¼ÓŠČēĻĀ×Ŗ»Æ¹ŲĻµ£ØĘäĖū·“Ó¦²śĪļ¼°·“Ó¦ĖłŠčĢõ¼ž¾łŅŃĀŌČ„£©£¬µ±XŹĒĒæ¼īŹ±£¬¹żĮæµÄBøśCl2·“Ó¦³żÉś³ÉCĶā£¬ĮķŅ»²śĪļŹĒŃĪĖįŃĪ”£
![]()
ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ£Ø £©
A. µ±XŹĒĒæĖįŹ±£¬A”¢B”¢C”¢D”¢E”¢FÖŠ¾łŗ¬Ķ¬Ņ»ÖÖŌŖĖŲ£¬FæÉÄÜŹĒH2SO4
B. µ±XŹĒĒæ¼īŹ±£¬A”¢B”¢C”¢D”¢E”¢FÖŠ¾łŗ¬Ķ¬Ņ»ÖÖŌŖĖŲ£¬FŹĒHNO3
C. BŗĶCl2µÄ·“Ó¦ŹĒŃõ»Æ»¹Ō·“Ó¦
D. µ±XŹĒĒæĖįŹ±£¬CŌŚ³£ĪĀĻĀŹĒĘųĢ¬µ„ÖŹ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÄæĒ°ŗ¬ÓŠŌŖĖŲĪų![]() µÄ±£½”Ę·ŅŃæŖŹ¼ÓæČėŹŠ³”£¬ŅŃÖŖĖüÓėŃõĶ¬Ö÷×壬¶ųÓėøĘĶ¬ÖÜĘŚ£¬ĻĀĮŠ¹ŲÓŚĪųµÄÓŠ¹ŲĆčŹöÖŠ²»ÕżČ·µÄŹĒ
µÄ±£½”Ę·ŅŃæŖŹ¼ÓæČėŹŠ³”£¬ŅŃÖŖĖüÓėŃõĶ¬Ö÷×壬¶ųÓėøĘĶ¬ÖÜĘŚ£¬ĻĀĮŠ¹ŲÓŚĪųµÄÓŠ¹ŲĆčŹöÖŠ²»ÕżČ·µÄŹĒ
A.Ō×ÓŠņŹżĪŖ24B.×īøß¼ŪŃõ»ÆĪļĪŖSeO3£¬ĪŖĖįŠŌŃõ»ÆĪļ
C.Ō×Ó°ė¾¶±ČøĘŠ”D.ĘųĢ¬Ēā»ÆĪļ·Ö×ÓŹ½ĪŖH2Se£¬ŹÜČČ½ĻČŻŅ×·Ö½ā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÜČ²Ė¼×ĖŲ”¢3-¶”Ļ©»ł±½ĢŖ”¢Ž»±¾ÄŚõ„ŹĒ“«Ķ³ÖŠŅ©µ±¹é”¢“ØÜŗÖŠµÄ»īŠŌ³É·Ö”£ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
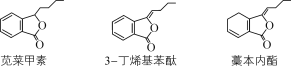
A.ÜČ²Ė¼×ĖŲ”¢Ž»±¾ÄŚõ„»„ĪŖĶ¬·ÖŅģ¹¹Ģå
B.1 mol 3-¶”Ļ©»ł±½ĢŖÓėäåĖ®·“Ó¦×ī¶ąĻūŗÄ4 mol Br2
C.3-¶”Ļ©»ł±½ĢŖĶعż»¹Ō·“Ó¦æÉÖʵĆÜČ²Ė¼×ĖŲ
D.Ž»±¾ÄŚõ„Óė×ćĮæH2¼Ó³ÉµÄ²śĪļ·Ö×ÓÖŠŗ¬ÓŠ2øöŹÖŠŌĢ¼Ō×Ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāĘųŹĒŅ»ÖÖĒå½ąÄÜŌ“£¬ĖüµÄÖĘČ”ÓėÓ¦ÓĆŅ»Ö±ŹĒČĖĄąŃŠ¾æµÄČČµć”£
(1)ÓĆ¼×“¼ŗĶĖ®ÕōĘųŌŚ“߻ƼĮ”¢¼ÓČČĢõ¼žĻĀÖĘĒāµÄĻą¹ŲČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
CH3OH(g)=CO(g)+2H2(g)£»¦¤H=+90.7 kJ/mol
CO(g)+H2O(g)=CO2(g)+H2(g)£»¦¤H=-41.2 kJ/mol
¢Ł·“Ó¦CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g)ÄÜ×Ō·¢½ųŠŠµÄŌŅņŹĒ________”£
CO2(g)+3H2(g)ÄÜ×Ō·¢½ųŠŠµÄŌŅņŹĒ________”£
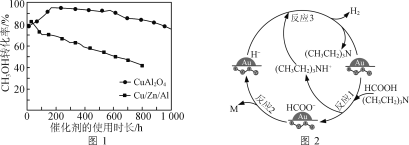
¢Ś½«Ņ»¶Ø±ČĄżµÄCH3OH(g)ŗĶH2O(g)µÄ»ģŗĻĘųĢ壬ŅŌĻąĶ¬ĖŁĀŹĶعż×°ÓŠ²»Ķ¬“߻ƼĮµÄ·“Ó¦Ę÷”£CH3OH×Ŗ»ÆĀŹĖę“߻ƼĮµÄŹ¹ÓĆŹ±³¤±ä»ÆČēĶ¼1ĖłŹ¾£¬“߻ƼĮCuAl2O4Óė“߻ƼĮCu/Zn/AlĻą±Č£¬ÓŵćÓŠ____________________”£
¢ŪĻņCu(NO3)2”¢Al(NO3)3»ģŗĻČÜŅŗÖŠµĪ¼ÓNaOHČÜŅŗæÉ»ńµĆ³ĮµķĪļ[Cu(OH)2”¢Al(OH)3]£¬ŅŌ±ćÓŚÖĘČ”CuAl2O4”£ĪŖČ·±£Cu2+”¢Al3+ĶźČ«³Įµķ£ØÅØ¶Č”Ü10-5 mol/L£©£¬Ó¦æŲÖĘ»ģŗĻŅŗpHµÄ×īŠ”ÕūŹżÖµĪŖ________{Ksp[Cu(OH)2]=2.2”Į10-20£¬Ksp[Al(OH)3]=1.3”Į10-33}”£
(2)ÓĆAu/ZrO2×÷“߻ƼĮ£¬ŌŚ(CH3CH2)3N×÷ÓĆĻĀHCOOH·Ö½āÖĘĒāµÄŌĄķČēĶ¼2ĖłŹ¾”£·“Ó¦2ÖŠÉś³ÉĪļMµÄ»ÆѧŹ½ĪŖ__________________£¬Ķ¼Ź¾·“Ó¦ÖŠÖ»ÓŠĒāŌŖĖŲ»ÆŗĻ¼Ū·¢Éś±ä»ÆµÄŹĒ·“Ó¦________£ØĢī”°1”±”°2”±»ņ”°3”±£©”£
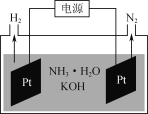
(3)ČēĶ¼ŹĒµē½ā°±Ė®ŗĶKOH»ģŗĻČÜŅŗÖĘĒāµÄ×°ÖĆŹ¾ŅāĶ¼”£Éś³ÉN2µÄµē¼«·“Ó¦Ź½ĪŖ______________”£
(4)ø»ŃõĢõ¼žĻĀ£¬H2»¹ŌNOx°üĄØĮ½øö½×¶Ī£ŗµŚŅ»½×¶ĪĪŖH2”¢NOxŌŚ“߻ƼĮ×÷ÓĆĻĀ×Ŗ±äĪŖH2O”¢N2”¢NH3£»µŚ¶ž½×¶ĪNH3ŌŚŌŲĢåĖįµÄ×÷ÓĆĻĀÉś³ÉNH4+£¬NH4+½«NOx»¹ŌĪŖN2”£Š“³öNOÓėO2µÄĪļÖŹµÄĮæÖ®±ČĪŖ1”Ć1Ź±£¬NH4+ÓėNO”¢O2·“Ӧɜ³ÉN2µÄĄė×Ó·“Ó¦·½³ĢŹ½£ŗ__________________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æijæóŌüµÄ³É·ÖĪŖCu2O”¢Al2O3”¢Fe2O3”¢FeO”¢SiO2£¬¹¤ŅµÉĻÓĆøĆæóŌü»ńČ”ĶŗĶµØ·ÆµÄ²Ł×÷Į÷³ĢČēĶ¼£ŗ
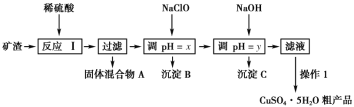
ŅŃÖŖ£ŗ¢ŁCu2O£«2H+=Cu£«Cu2+£«H2O”£
¢Ś²æ·ÖŃōĄė×ÓŅŌĒāŃõ»ÆĪļŠĪŹ½³ĮµķŹ±ČÜŅŗµÄpHČēĻĀ±ķĖłŹ¾£ŗ
³ĮµķĪļ | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
æŖŹ¼³ĮµķpH | 5.4 | 4.0 | 2.7 | 5.8 |
³ĮµķĶźČ«pH | 6.7 | 5.2 | 3.7 | 8.8 |
£Ø1£©ĪŖĮĖ¼Óæģ·“Ó¦¢ńµÄĖŁĀŹ£¬æÉŅŌ²ÉČ”µÄ“ėŹ©ŹĒ__(ČĪŠ“1Ģõ)”£
£Ø2£©¹ĢĢå»ģŗĻĪļAÖŠµÄ³É·ÖŹĒ__”£
£Ø3£©·“Ó¦¢ńĶź³Éŗó£¬ĢśŌŖĖŲµÄ“ęŌŚŠĪŹ½ĪŖ__(ĢīĄė×Ó·ūŗÅ)£»¼ģŃéøĆĄė×Ó³£ÓƵķ½·ØÖ®Ņ»ŹĒ£ŗȔɣĮæŗ¬øĆĄė×ÓµÄČÜŅŗÓŚŹŌ¹ÜÖŠ£¬µĪ¼Ó¼øµĪĢśĒč»Æ¼ŲČÜŅŗ£¬»į²śÉś³Įµķ£¬Š“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½__”£
£Ø4£©²Ł×÷1Ö÷ŅŖ°üĄØ£ŗ__”¢__”¢__”£Ļ“µÓCuSO4”¤5H2O“Ö²śĘ·²»ÄÜÓĆ“óĮæĖ®Ļ“£¬¶ųÓƱłĖ®Ļ“µÓ”£ŌŅņŹĒ__”£
£Ø5£©ÓĆNaClOµ÷pHæÉŅŌÉś³É³ĮµķB£¬ĄūÓĆĢāÖŠĖłøųŠÅĻ¢·ÖĪö³ĮµķBĪŖ__£¬øĆ·“Ó¦ÖŠŃõ»Æ¼ĮÓė»¹Ō¼ĮµÄĪļÖŹµÄĮæÖ®±ČĪŖ__”£
£Ø6£©ÓĆNaOHµ÷pHæÉŅŌÉś³É³ĮµķC£¬ĄūÓĆĢāÖŠĖłøųŠÅĻ¢·ÖĪöyµÄ·¶Ī§ĪŖ__”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
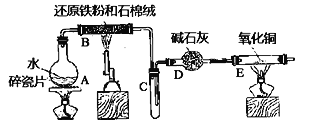
”¾ĢāÄæ”æijŹµŃ銔×éĄūÓĆĻĀĶ¼ĖłĮŠ×°ÖĆ½ųŠŠ”°ĢśÓėĖ®ÕōĘų·“Ó¦”±µÄŹµŃ飬²¢ĄūÓĆ²śĪļ½ųŅ»²½ÖĘČ”FeCl3”¤6H2O¾§Ģ唣£ØĶ¼ÖŠ¼Š³Ö¼°Ī²Ęų“¦Ąķ×°ÖĆ¾łŅŃĀŌČ„£©
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©×°ÖĆBÖŠ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ŹĒ__________
£Ø2£©EÖŠ³öĻÖ______________µÄĻÖĻó”£
£Ø3£©øĆŠ”×é°ŃBÖŠ·“Ó¦ŗóµÄ²śĪļ¼ÓČė×ćĮæµÄŃĪĖį£¬ÓĆøĆČÜŅŗÖĘČ”FeCl3”¤6H2O¾§Ģ唣
¢ŁÓū¼ģŃéČÜŅŗÖŠŗ¬ÓŠFe3+£¬Ń”ÓƵďŌ¼ĮĪŖ____________£¬ĻÖĻóŹĒ__________
¢ŚøĆŹµŃ銔×éĶ¬Ń§ÓĆÉĻŹöŹŌ¼Įƻӊ¼ģ²āµ½Fe3+£¬ÓĆĄė×Ó·½³ĢŹ½½āŹĶĀĖŅŗÖŠ²»“ęŌŚFe3+æÉÄܵĵÄŌŅņ£ŗ___________”£
¢Ū½«“ĖĀĖŅŗÖŠFeCl2ĶźČ«Ńõ»ÆĪŖFeCl3×īŗĆŃ”Ōń_______×öŃõ»Æ¼Į”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ«ŃōÄܵē³ŲŌŚČÕ³£Éś»īÖŠŅŃ¹ć·ŗÓ¦ÓĆ£¬Ņ»ÖÖĢę“ś¹č¹āµē³ŲµÄČ«ĢģŗņĢ«ŃōÄܵē³ŲŅŃĶ¶ČėÉĢÓĆ£¬Ę乤×÷ŌĄķČēĶ¼”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø£©
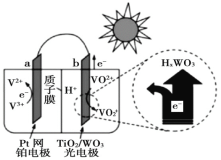
A.¹čĢ«ŃōÄܵē³Ų¹¤×÷ŌĄķÓėøƵē³Ų²»ĻąĶ¬
B.Ņ¹¼äŹ±£¬øƵē³ŲĻąµ±ÓŚŠīµē³Ų·Åµē£¬a ¼«·¢ÉśŃõ»Æ·“Ó¦
C.¹āÕÕŹ±£¬b ¼«µÄµē¼«·“Ó¦Ź½ĪŖVO2+©e©+H2O£½VO![]() +2H+
+2H+
D.¹āÕÕŹ±£¬Ćæ×ŖŅĘ 1mol µē×Ó£¬ÓŠ 2 mol H+ ÓÉ b ¼«Ēų¾ÖŹ×Ó½»»»Ä¤Ļņ a ¼«ĒųĒØŅĘ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŃįŃõ°±»Æ·Ø£ØAnammox£©ŹĒŅ»ÖÖŠĀŠĶµÄ°±µŖČ„³ż¼¼Źõ£¬ĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ

A. 1mol NH4+ Ėłŗ¬µÄÖŹ×Ó×ÜŹżĪŖ10NA
B. ĮŖ°±£ØN2H4£©ÖŠŗ¬ÓŠ¼«ŠŌ¼üŗĶ·Ē¼«ŠŌ¼ü
C. ¹ż³ĢIIŹōÓŚŃõ»Æ·“Ó¦£¬¹ż³ĢIVŹōÓŚ»¹Ō·“Ó¦
D. ¹ż³ĢIÖŠ£¬²ĪÓė·“Ó¦µÄNH4+ÓėNH2OHµÄĪļÖŹµÄĮæÖ®±ČĪŖ1:1
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com