

 .
.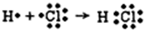 .
.
分析 由元素在周期表中的位置可知知,①一⑨元素分别是H、C、N、O、Na、Al、Si、S、Cl元素,
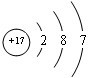
(1)第三周期中元素非金属性最强的元素是Cl元素,Cl原子核外有3个电子层,三个电子层上的电子数分别是2、8、7;
(2)元素的非金属性越强,其最高价氧化物对应水化物酸性越强;
(3)⑨的氢化物是HCl,H原子和Cl原子通过共用电子对形成HCl分子;
(4)金属的金属性强弱判断方法有:金属与水或酸反应速率快慢、金属的最高价氧化物的水化物碱性强弱、金属之间的置换反应等;
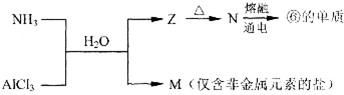
(5)氨水和AlCl3溶液发生反应3NH3.H2O+AlCl3=Al(OH)3↓+3NH4Cl,Z加热生成N,N电解得到Al,则Z是Al(OH)3、N是Al2O3,M是NH4Cl.
解答 解:由元素在周期表中的位置知,①一⑨元素分别是H、C、N、O、Na、Al、Si、S、Cl元素,
(1)第三周期中元素非金属性最强的元素是Cl元素,Cl原子核外有3个电子层,三个电子层上的电子数分别是2、8、7,其原子结构示意图为 ,
,
故答案为: ;
;
(2)非金属性N>C>Si,所以酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)⑨的氢化物是HCl,H原子和Cl原子通过共用电子对形成HCl分子,其形成过程为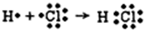 ,故答案为:
,故答案为: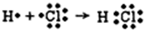 ;
;
(4)金属的金属性越强,金属与水或酸反应速率越快、金属的最高价氧化物的水化物碱性越强,金属的金属性强弱与元素化合价、单质的熔点无关,故选cd;
(5)氨水和AlCl3溶液发生反应3NH3.H2O+AlCl3=Al(OH)3↓+3NH4Cl,Z加热生成N,N电解得到Al,则Z是Al(OH)3、N是Al2O3,M是NH4Cl,
a.Z的化学式是NH4Cl,故答案为:Al(OH)3;
b.N生成⑥的单质反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀溶液的pH,测定值可能偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率,对逆反应速率无影响 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg Al | 稀盐酸 | 偏向Al |
| ② | Al Cu | 稀盐酸 | 偏向Cu |
| ③ | Al 石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al Cu | 浓硝酸 | 偏向Al |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com