

分析 (1)过碳酸钠与稀硫酸反应放出O2和CO2,反应的离子方程式为2CO42-+4H+→O2↑+2H2O+2CO2↑,据此计算反应产物中O2和CO2的物质的量之比;
(2)检验过碳酸钠样品中是否含有氯元素,将样品溶于足量的稀硫酸,再加入足量的硝酸钡,过滤后在滤液中加硝酸酸化的硝酸银,若有白色沉淀,则样品中含有氯元素,据此答题;
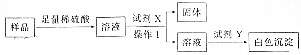
(3)根据装置图可知,在A装置中将样品与稀硫酸反应生成气体二氧化碳,由于二氧化碳中有水蒸气,所以要除去,B装置中用浓硫酸干燥二氧化碳,C装置吸收生成的二氧化碳,根据C装置的质量的变化可知二氧化碳的质量,根据二氧化碳的质量计算样品中过碳酸钠的质量,充分反应后再通入N2一段时间,使装置中的二氧化碳能充分被C装置吸收,为防止空气中的二氧化碳和水蒸气对实验的影响,在C装置后面连接D装置可以防止空气中的二氧化碳和水蒸气进入C装置,据此答题.
解答 解:(1)过碳酸钠与稀硫酸反应放出O2和CO2,反应的离子方程式为2CO42-+4H+→O2↑+2H2O+2CO2↑,所以反应产物中O2和CO2的物质的量之比为1:2,
故答案为:1:2;
(2)检验过碳酸钠样品中是否含有氯元素,将样品溶于足量的稀硫酸,再加入足量的硝酸钡,过滤后在滤液中加硝酸酸化的硝酸银,若有白色沉淀,则样品中含有氯元素,
①根据上面的分析可知,操作1的名称是过滤,用到的玻璃仪器除烧杯、漏斗外还有玻璃棒,
故答案为:过滤;玻璃棒;
②根据上面的分析可知,试剂X是 硝酸钡,试剂Y是 硝酸酸化的硝酸银溶液,
故答案为:硝酸钡;硝酸酸化的硝酸银溶液;
(3)根据装置图可知,在A装置中将样品与稀硫酸反应生成气体二氧化碳,由于二氧化碳中有水蒸气,所以要除去,B装置中用浓硫酸干燥二氧化碳,C装置吸收生成的二氧化碳,根据C装置的质量的变化可知二氧化碳的质量,根据二氧化碳的质量计算样品中过碳酸钠的质量,充分反应后再通入N2一段时间,使装置中的二氧化碳能充分被C装置吸收,为防止空气中的二氧化碳和水蒸气对实验的影响,在C装置后面连接D装置可以防止空气中的二氧化碳和水蒸气进入C装置,
①通过分液漏斗加入稀硫酸时,旋开分液漏斗旋塞发现没有液体留下,原因可能是分液漏斗的上口塞没打开,
故答案为:分液漏斗的上口塞没打开;
②根据上面的分析可知,B中试剂是 浓硫酸,D装置的作用是 防止空气中的二氧化碳和水蒸气进入C装置,
故答案为:浓硫酸;防止空气中的二氧化碳和水蒸气进入C装置;
③若实验结束后测得C装置的质量增加了1.1g,即产生的0.025mol的二氧化碳,根据2CO42-+4H+→O2↑+2H2O+2CO2↑可知,Na2CO4的质量为0.025mol×122g/mol=3.05g,样品的纯度为$\frac{3.05}{3.2}$×100%=95.3%,若没有通入N2的设计,有部分二氧化碳会留在装置中,不能被C装置吸收,导致测定结果偏低,
故答案为:95.3%;偏低.
点评 本题考查了性质实验方案的设计,涉及氧化还原反应、化学实验基本操作方法应用、化学计算等知识,明确实验目的及反应原理为解答关键,试题培养了学生的分析能力及化学实验能力,难度中等.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 萃取操作中,分液漏斗振摇后需要放气,放气的具体操作为,将分液漏斗置于铁架台的铁圈上,打开上口玻璃塞 | |
| B. | 燃料电池制作中,为了能吸附更多气体,在两根碳棒表面包上一层薄海绵 | |
| C. | 用硫代硫酸钠溶液和硫酸溶液反应测反应速率是实验中,可以通过判断气泡多少来比较反应速率快慢 | |
| D. | 酸碱中和滴定操作中,用酸润洗过的滴定管需要用蒸馏水再润洗一次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl溶液 | B. | Ca(OH)2悬浊液 | C. | Fe(OH)3胶体 | D. | 油漆等乳浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应放出太量的热,因此可以用于冶炼高熔点金属 | |
| B. | 二氧化硅是一种熔沸点很高、硬度很大的氧化物 | |
| C. | 金刚石和石墨的化学性质相似,它们互为同素异形体 | |
| D. | 银白色的镁条在空气中剧烈燃烧后得到淡黄色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小:c[(NH4)2Fe(SO4)2]<c[(NH4)2SO4]<c(NH4Cl) | |
| B. | 室温下若0.3mol•L-1HY溶液与0.3mol•L-1NaOH溶液等体积混合后,溶液的pH=9,则c(OH-)-c(HY)=c(H+)=1×10-9mol•L-1 | |
| C. | 室温下0.2mol•L-1HCl溶液与等体积0.05mol•L-1Ba(OH)2溶液混合后,溶液的pH=1 | |
| D. | NaHCO3溶液中:c(OH-)═c(H+)+c(H2CO3)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②⑤ | C. | ④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com