
25℃时,pH=2的HCl溶液中,由水电离的H+浓度是
A.1×10-7mol﹒L-1 B.1×10-12mol﹒L-1
C.1×10-2mol﹒L-1 D.1×10-14mol﹒L-1
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2016-2017学年广西桂林十八中高二上期中理化学卷(解析版) 题型:选择题
用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是
A. 苯中的甲苯(溴水、分液) B. 溴乙烷中的乙醇(水、分液)
C. 乙醇中的水(CaO、蒸馏) D. 溴苯中的溴(NaOH溶液、分液)
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
下列说法正确的是
①离子化合物一定含离子键,也可能含极性键
②共价化合物可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在化学键
⑥熔融状态下能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等, 其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,部分含
其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。某温度下,部分含 氯组分含量随pH变化情况如图所示,下列说法不正确的是
氯组分含量随pH变化情况如图所示,下列说法不正确的是
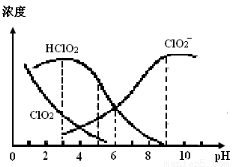
A.使用该漂白剂的适宜pH约为5.0
B.该温度下NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C.该温度下HClO2的电离平衡常数的数值Ka≈1.0×10-6
D.不同pH的NaClO2溶液中存在下列关系:c(Na+)= c(ClO2-)+ c(HClO2)+ c(ClO2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:填空题
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度℃ | 450 | 475 | 500 | 525 | 550 | 575 | 600 | 650 |
SO2的转化率% | 97.5 | 95.8 | 95.8 | 93.5 | 90.50 | 85.6 | 80.0 | 73.7 |
(1)能判断该反应是否达到平衡状态的是
A.容器的压强不变
B.混合气体的密度不变
C.混合气体中SO3的浓度不变
D.C(SO2)=C(SO3)
E.v正(SO2)=v正(SO3)
F.v正(SO3)=2v逆(O2)
(2)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1,
①此时的温度为 ℃
②若将平衡反应混合物的压强增大1倍(假如体积可变),此时Qc为 (可用分数表示),平衡将 向移动。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
某固定体积的密闭容器中,加入—定量的A达化学平衡: aA(g) B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
B(g)+c(g),在温度不变的条件下,再充入一定量的A物质,重新达到平衡时,下列判断中正确的是
A.若a=b+c时,B的物质的量分数变大 B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变 D.若a<b+c时,A的转化率变大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度
A.偏高 B.偏低 C.不受影响 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:填空题
(1)已知反应 2HI(g) H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
H2(g)+I2(g)的 ΔH=+11kJ/mol, 1mol H2(g)、 1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1mol HI(g)分子中化学键断裂时需吸收的能量为_________kJ。
(2)Bodensteins 研究了下列反应:2HI(g)  H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
H2(g)+I2(g)在 716 K 时,气体混合物中碘化氢的物质的量分数 x(HI)与反应时间 t 的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为__________(以K和k正表示)。若 k正=0.0027 min-1,在 t=40min 时,v正=_________ min-1。
③由上述实验数据计算得到v正~x(HI)和 v逆~x(H2)的关系如图所示。当升高到某一温度时,反应重新达到平衡,相应的点依次为__________(填字母)和__________(填字母)。
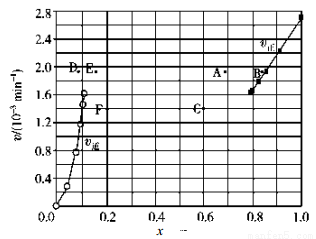
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
在Na+浓度为0.9 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子:取该溶液100ml进行如下实验(气体体积在标准状况下测定):
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
I.向该溶液中加入足量稀HCl,产生白色沉淀并放出1.12L气体;II.将I的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称得固体质量为3.6g;III.在II的滤液中滴加BaCl2溶液,无明显现象,下列说法不正确的是( )
A.K+一定存在,且c(K+)≤1.3mol·L-1
B.实验I能确定一定不存在的离子是Ag+、Mg2+、Ba2+
C.实验I中生成沉淀的离子方程式为SiO32-+2H+=H2SiO3↓
D.实验III能确定一定不存在SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com