
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
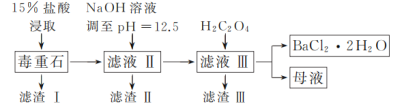
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【答案】既加快反应速度又提高浸取率 SiO2、BaSO4 防止生成BaC2O4 ABD 除去表面附着的Ba2+,防止污染环境 灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶
【解析】
毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)加入盐酸溶解,生成氯化钙、氯化镁、氯化钡和氯化铁,且少量硫酸根离子与钡离子反应生成硫酸钡,滤渣Ⅰ为SiO2、BaSO4;加入氢氧化钠溶液调至pH=12.5,铁离子、镁离子转化为氢氧化镁、氢氧化铁沉淀进入滤渣Ⅱ,滤液为氯化钡、氯化钙、氯化钠和氢氧化钠,加入草酸反应生成草酸钙沉淀,即滤渣Ⅲ为草酸钙;滤液Ⅲ蒸发浓缩、冷却结晶得到氯化钡晶体。据此分析解答。
(1)盐酸浸取时,适当加热,可以加快反应速度,提高浸取率,故答案为:既加快反应速度又提高浸取率;
(2)酸溶时,SiO2不溶于盐酸和水,且溶液中的SO42-和Ba2+反应生成BaSO4沉淀,则过滤所得滤渣Ⅰ的成分为SiO2、BaSO4,故答案为:SiO2、BaSO4;
(3)加入H2C2O4的目的是除去溶液中的Ca2+,但草酸过量时,也会生成BaC2O4沉淀,故答案为:防止生成BaC2O4;
(4)用37%的盐酸配制15%的盐酸,需要用量筒量取适量的37%的盐酸倒入烧杯中,然后向烧杯中加入一定量的蒸馏水,用玻璃棒搅拌均匀即可,需用到的仪器有量筒、烧杯、玻璃棒,故答案为:ABD;
(5)滤渣Ⅲ为草酸钙,溶液中的氯化钡吸附在草酸钙的表面,钡离子属于重金属离子,会污染环境,因此需经过洗涤后才能进行后续加工处理,故答案为:除去表面附着的Ba2+,防止污染环境;
(6)用碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O,根据题给试剂,可以首先将碳酸钡石粉碎煅烧,使碳酸钡石分解,因为氢氧化钙的溶解度较小,且温度越高,溶解度越小,然后用80℃热水溶解固体,趁热过滤,除去氢氧化钙,将生成的氢氧化钡用6mol·L-1盐酸中和,得到氯化钡溶液,蒸发浓缩,冷却结晶得到BaCl2·2H2O粗品,过滤,用无水乙醇洗涤2~3次,低温干燥即可,故答案为:灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶。


科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硝酸中,过滤,除去杂质,在滤液中加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。上述沉淀和残渣分别为 ()
A.Fe(OH)3;Fe2O3B.Fe(OH)2 ;FeOC.Fe(OH)3 ;Fe(OH)2 ;Fe3O4D.Fe2O3;Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成.丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉.羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的空间构型为:_______;与SCN- 互为等电子体的分子有:__________________(填分子式)
(5)“NiO”晶胞如图:
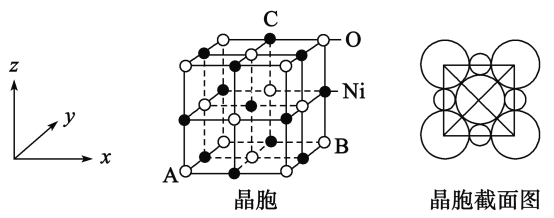
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CsF是离子晶体,其晶格能可通过下图的循环计算得到,以下说法错误的是
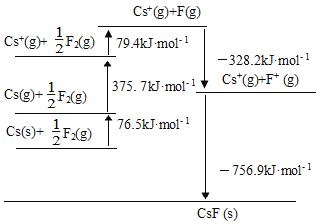
A. Cs原子的第一电离能为452.2 kJ·mol1
B. F-F键的键能为158.8 kJ·mol1
C. CsF的晶格能756.9kJ·mol1
D. 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡元素形成的化合物在生产中有重要的用途,请根据信息回答下列问题:
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)黄铜是最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)___Ⅰ1(Cu)(填“>”或“<”) ,原因是____。
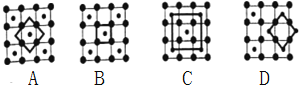
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图,其中不能描述CoO2的化学组成的是____(填字母)。
(4)在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图)和H+,常用于检验Ni2+。在丁二酮肟镍中,不存在的作用力有____。
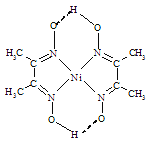
A 配位键 B 离子键 C σ键 D π键 E 金属键 F 氢键
(5)Co3+ 的一种配离子[Co(N3) (NH3)5]2+中,配体有_____,1mol该配离子中所含σ键的数目______。
(6)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____,该立方体中Fe2+间连接起来形成的空间构型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. 1 molN2与4molH2混合充分反应,则转移的电子数目为6mol
B. 向0.1mol·L-1CH3COONa溶液中加入少量水,溶液中![]() 减小
减小
C. 常温下,C(s)+H2O(g)![]() CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
CO(g)+H2(g)不能自发进行,则该反应的ΔH>0
D. HCl和NaOH反应的中和热为-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热为-114.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如图1所示:
图1:
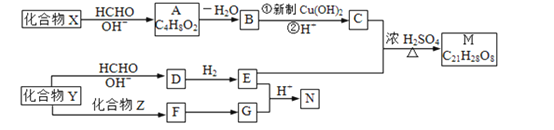
已知:i、-CHO+![]()
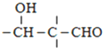
ii、RCHO+![]()
![]()
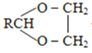 +H2O
+H2O
iii、N的结构简式是
请回答下列问题:
(1)A中含氧官能团名称是______________,由A生成B的反应类型是___________。
(2)写出下列物质的结构简式:X:_________Z:______________E:______
(3)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式是:____。
(4)G中碳原子________(填“一定”、“不一定”或“一定不”)在同一平面内;1mol G一定条件下,最多能与________mol H2发生反应;与G含有相同官能团的同分异构体(不包含G)有___________种。
(5)由Y生成D的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )

A. 该温度下Ksp(CuS)=10-35.4
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. Na2S溶液中C(S2-)+C(HS-)+C(H2S)=2C(Na+)
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com