
| A、NH3 |
B、 |
| C、H2S |
| D、C2H5OH |
科目:高中化学 来源: 题型:
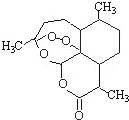 被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )
被誉为中国“新四大发明”的复方蒿甲醚是第一个由中国发现的全新化学结构的药品,也是目前在国际上获得广泛认可的中国原创药品.至今已被多个亚非国家指定为疟疾治疗一线用药,它在疟疾这一高传染性疾病治疗史上具有里程碑意义.其主要成分是青蒿素(是一种由青蒿中分离得到的具有新型化学结构的抗疟药),结构如图所示.有关该化合物的叙述正确的是( )| A、分子式为:C15H24O5 |
| B、该化合物在一定条件下不能与NaOH溶液反应 |
| C、该化合物中含有过氧键,一定条件下有氧化性 |
| D、青蒿素与维生素一样是水溶性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:D>C>B |
| B、单质的还原性:D>C |
| C、元素A、B、C的氧化物均为共价化合物 |
| D、元素B、C、D的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、卤素单质从F2到I2,颜色加深,熔沸点升高 |
| B、卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱 |
| C、卤族元素从F到I,HX水溶液酸性增强 |
| D、卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、共价化合物中一定只含有极性共价键 |
| B、只含有共价键的物质一定是共价化合物 |
| C、离子化合物中可能含有极性共价键或非极性共价键 |
| D、有较强共价键存在的物质熔沸点一定很高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤ | B、③④⑤ |
| C、②③⑤ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、等pH的溶液物质的量浓度关系:C(NaCN)>C(Na2CO3)>C(CH3COONa) |
| B、amol/L HCN与b mol/LNaOH溶液等体积混合后所得溶液中c(Na+)>c(CN-),则a一定小于b |
| C、相同体积相同浓度的NaCN 和CH3COONa溶液中,NaCN溶液的离子总数少 |
| D、HCN+CO32-→CN-+H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com