
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______.
(2)W与Y可形成化合物W2Y,该化合物的电子式为______.
(3)Y在周期表中的位置是______.
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同):______;比较Y、Z的气态氢化物稳定性强弱:______>______.
(5)X的硝酸盐水溶液显______性,用离子方程式解释原:______.
(6)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为:______.
(7)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:______.
(8)以N2、H2 为电极反应物,以HCl—NH4Cl为电解质溶液制造新型燃料电池,放电过程中,溶液中NH4+浓度逐渐增大,写出该电池的正极反应式:_______.
【答案】Al(OH)3+OH﹣=AlO2﹣+2H2O![]() 第三周期第ⅥA族S 2﹣>Cl﹣>Na+>Al3+HClH2S酸性Al3++3H2O
第三周期第ⅥA族S 2﹣>Cl﹣>Na+>Al3+HClH2S酸性Al3++3H2O![]() Al(OH)3+3H+SO2+Cl2+2H2O═H2SO4+2HClCl2O7(l)+H2O(l)═2HClO4(aq)△H=﹣4QkJmol﹣1N2+8H++6e-=2NH4+
Al(OH)3+3H+SO2+Cl2+2H2O═H2SO4+2HClCl2O7(l)+H2O(l)═2HClO4(aq)△H=﹣4QkJmol﹣1N2+8H++6e-=2NH4+
【解析】
通过题给问题分析可知,W、X是金属元素,Y、Z是非金属元素;W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,W为钠,X为铝;W与Y可形成化合物W2Y,Y为硫,因为W、X、Y、Z是原子序数依次增大的同一短周期元素,所以Z为氯;据以上分析解答。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W是金属钠,X是金属铝,氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水,该反应的离子方程式为:Al(OH)3+OH﹣=AlO2﹣+2H2O ;正确答案:Al(OH)3+OH﹣=AlO2﹣+2H2O。
(2) W是金属钠,W与Y可形成化合物W2Y,则Y是非金属硫,硫化钠使钠离子和硫离子间通过离子键形成的离子化合物,电子式为:![]() ;正确答案:
;正确答案:![]() 。
。
(3)Y为硫元素,核电荷数为16,原子结构示意图为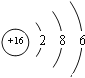 ,在周期表中的位置是第三周期第ⅥA族;正确答案:第三周期第ⅥA族。
,在周期表中的位置是第三周期第ⅥA族;正确答案:第三周期第ⅥA族。
(4)W为钠,X为铝,Y为硫,Z为氯,四种元素简单离子分别为Na+ 、Al3+ 、S 2﹣、Cl﹣;核外电子排布相同的离子,核电荷数越大,离子半径越小,所以:S 2﹣>Cl﹣,Na+>Al3+ ;电子层数多的,离子半径大,所以四种元素简单离子的半径大小S 2﹣>Cl﹣>Na+>Al3+;Y、Z的气态氢化物分别为H2S和HCl,由于非金属性Cl> S,所以气态氢化物稳定性HCl>H2S;正确答案:S 2﹣>Cl﹣>Na+>Al3+;HCl H2S。
(5)X为铝,硝酸铝为强酸弱碱盐,铝离子能够水解,离子方程式:Al3++3H2O![]() Al(OH)3+3H+ 水解后溶液显酸性;正确答案:酸性; Al3++3H2O
Al(OH)3+3H+ 水解后溶液显酸性;正确答案:酸性; Al3++3H2O![]() Al(OH)3+3H+ 。
Al(OH)3+3H+ 。
(6)Y为硫,Z为氯,Y的低价氧化物为SO2通入Cl2的水溶液中,发生反应生成硫酸和盐酸,化学方程式为: SO2+Cl2+2H2O═H2SO4+2HCl;正确答案:SO2+Cl2+2H2O═H2SO4+2HCl。
(7)Z为氯,氯的最高价氧化物为Cl2O7, Cl2O7(l)与水反应生成HClO4,0.25mol Cl2O7(l)与水反应生成HClO4放出Q kJ的热量,则1mol Cl2O7(l)与水反应生成HClO4放出4Q kJ的热量,反应的热化学方程式:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=﹣4QkJmol﹣1;正确答案:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=﹣4QkJmol﹣1。
(8)在N2+3H2=2NH3反应中,氮气做氧化剂,在正极得电子被还原为NH3,在HCl—NH4Cl为电解质溶液中,N2被还原的产物为NH4+,正极反应式: N2+8H++6e-=2NH4+;正确答案:N2+8H++6e-=2NH4+。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】向仅含 Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如下图所示。下列说 法中正确的是
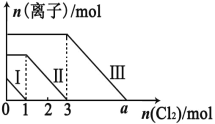
A. 线段Ⅲ代表 Fe2+的变化情况
B. 线段Ⅰ代表 Br -的变化情况
C. 原混合溶液中 n(FeBr2)=4mol
D. a 数值等于 6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能说明元素的金属性或非金属性相对强弱的是
序号 | 事实 | 推论 |
A | 与冷水反应,Na比Mg剧烈 | 金属性:Na > Mg |
B | Ca(OH)2的碱性强于Mg(OH)2 | 金属性:Ca > Mg |
C | SO2与NaHCO3溶液反应生成CO2 | 非金属性:S > C |
D | t℃时,Br2+H2 I2+H2 | 非金属性:Br > I |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素,是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:
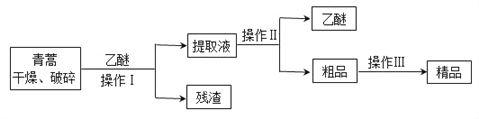
请回答下列问题:
(1)对青蒿进行干燥破碎的目的是____________________。
(2)操作Ⅰ需要的玻璃仪器主要有:烧杯、漏斗、_______,操作Ⅱ的名称是_______。
(3)操作Ⅲ的主要过程可能是_______(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.20g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。
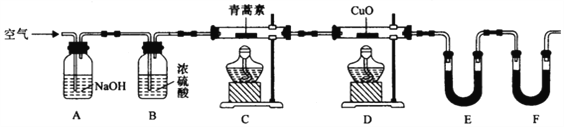
①装置E,F中盛放的物质分别是__________,____________。
②用合理改进后的装置进行试验,称得:
装置 | 实验前/g | 实验后/g |
E | 22.6 | 42.4 |
F | 80.2 | 146.2 |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为_______。
③该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,CrO42和Cr2O72在溶液中可相互转化,K2Cr2O7溶液中存在平衡:Cr2O![]() (橙色)+H2O
(橙色)+H2O![]() 2CrO
2CrO![]() (黄色)+2H+ 回答下列问题:
(黄色)+2H+ 回答下列问题:
(1)CrO42和Cr2O72在溶液中可相互转化,用K2Cr2O7溶液进行下列实验:

结合实验,下列说法正确的是________
A.①中溶液橙色加深,③中溶液变黄
B.②中Cr2O![]() 被C2H5OH氧化
被C2H5OH氧化
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.若向④中加入70% H2SO4溶液至过量,溶液变为橙色
(2)室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。
②根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_____0 (填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl 恰好完全沉淀(浓度等于1.0×105mol·L1)时,溶液中c(Ag+)为_______ mol·L1,此时溶液中c(CrO42)等于__________ mol·L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com