
ЎҫМвДҝЎҝПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A.·ҙУҰA(g)2B(g)ЎчHЈ¬ИфХэ·ҙУҰөД»о»ҜДЬОӘEakJЎӨmol-lЈ¬Дж·ҙУҰөД»о»ҜДЬОӘEbkJЎӨmol-lЈ¬ФтЎчH=-(Ea-Eb)kJЎӨmol-l
B.ДіОВ¶ИПВЈ¬ВИ»ҜДЖФЪЛ®ЦРөДИЬҪв¶ИКЗ20gЈ¬ФтёГОВ¶ИПВөДұҘәНВИ»ҜДЖИЬТәИЬЦКөДЦКБҝ·ЦКэОӘ20%
C.Ҫ«0.2molЎӨL-1өДCH3COOHИЬТәУл0.1molЎӨL-1өДNaOHИЬТәөИМе»э»мәПәуЈ¬ИЬТәЦРУР№ШБЈЧУөДЕЁ¶ИВъЧгПВБР№ШПөЈә2c(H+)-c(OH-)=c(CH3COO-)-c(CH3COOH)
D.Ҫ«ЕЁ¶ИОӘ0.1molЎӨL-1HFИЬТәјУЛ®І»¶ППЎКН№эіМЦРЈ¬өзАлЖҪәвіЈКэKa(HF)ұЈіЦІ»ұдЈ¬![]() КјЦХұЈіЦФцҙу
КјЦХұЈіЦФцҙу
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
AЎў![]() Хэ·ҙУҰөД»о»ҜДЬ
Хэ·ҙУҰөД»о»ҜДЬ![]() Дж·ҙУҰөД»о»ҜДЬ
Дж·ҙУҰөД»о»ҜДЬ![]() Ј¬№КAҙнОуЈ»
Ј¬№КAҙнОуЈ»
BЎўұҘәНИЬТәөДЦКБҝ·ЦКэәНИЬҪв¶ИЦ®јдөД№ШПөЈә![]() Ј¬ёГОВ¶ИПВөДұҘәНВИ»ҜДЖИЬТәөДИЬЦКЦКБҝ·ЦКэРЎУЪ
Ј¬ёГОВ¶ИПВөДұҘәНВИ»ҜДЖИЬТәөДИЬЦКЦКБҝ·ЦКэРЎУЪ![]() Ј¬№КBҙнОуЈ»
Ј¬№КBҙнОуЈ»
CЎў![]() өД
өД![]() ИЬТәУл
ИЬТәУл![]() өДNaOHИЬТәөИМе»э»мәПәуЈ¬өГөҪөДКЗөИЕЁ¶ИөДҙЧЛбәНҙЧЛбДЖөД»мәПОпЈ¬ҙжФЪөзәЙКШәгЈә
өДNaOHИЬТәөИМе»э»мәПәуЈ¬өГөҪөДКЗөИЕЁ¶ИөДҙЧЛбәНҙЧЛбДЖөД»мәПОпЈ¬ҙжФЪөзәЙКШәгЈә![]() Ј¬ҙжФЪОпБПКШәгЈә
Ј¬ҙжФЪОпБПКШәгЈә![]() Ј¬ХыАнБҪКҪөГөҪЈә
Ј¬ХыАнБҪКҪөГөҪЈә![]() Ј¬№КCХэИ·Ј»
Ј¬№КCХэИ·Ј»
DЎўјУЛ®ПЎКНҙЩҪшHFөзАлЈ¬ОВ¶ИІ»ұдЈ¬өзАлЖҪәвіЈКэІ»ұдЈ¬өұҪУҪьЦРРФКұЈ¬ЗвАлЧУЕЁ¶ИҪУҪь10-7 mol/LЈ¬·ъАлЧУЕЁ¶ИјМРшјхРЎЈ¬¶юХЯұИЦөјхРЎЈ¬№КDҙнОуЎЈ
№КСЎЈәCЎЈ


 ҝЪЛгМвҝЁұұҫ©ёҫЕ®¶щНҜіц°жЙзПөБРҙр°ё
ҝЪЛгМвҝЁұұҫ©ёҫЕ®¶щНҜіц°жЙзПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝРҙіцПВБР·ҙУҰөДИИ»ҜС§·ҪіМКҪЎЈ
ЈЁ1Ј©ТСЦӘ¶ПҝӘ1molHЎӘHјьЎў1molNЎӘHјьЎў1molNЎФNјьРиТӘөДДЬБҝ·ЦұрКЗ436kJЎў391kJЎў946kJЈ¬ФтN2УлH2·ҙУҰЙъіЙNH3өДИИ»ҜС§·ҪіМКҪОӘ_______________________________
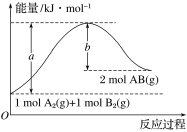
ЈЁ2Ј©ТСЦӘ»ҜС§·ҙУҰA2(g)Ј«B2(g)===2AB(g)өДДЬБҝұд»ҜИзНјЛщКҫЈ¬ЗлРҙіцёГ·ҙУҰөДИИ»ҜС§·ҪіМКҪЈә_______________________________________________
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝіЈОВПВЈ¬јёЦЦОпЦКөДөзАлЖҪәвіЈКэИзұнЈәПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
HCOOH | CH3COOH | NH3ЎӨH2O | |
Ka | 1.77ЎБ10-4 | 1.75ЎБ10-5 | 1.76ЎБ10-5 |
A.ЕЁ¶ИПаН¬өДHCOOHИЬТәУлNH3ЎӨH2OИЬТәөИМе»э»мәПЈ¬ЛщөГИЬТәПФјоРФ
B.УГПаН¬ЕЁ¶ИөДNaOHИЬТә·ЦұрөО¶ЁөИМе»эpHҫщОӘ3өДHCOOHәНCH3COOHИЬТәЈ¬HCOOHПыәДNaOHИЬТәөДМе»эҙу
C.0.2molЎӨL-1HCOOHУл0.1molЎӨL-1NaOHөИМе»э»мәПәуөДИЬТәЦРЈәc(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2molЎӨL-1CH3COONaУл0.1molЎӨL-1СОЛбөИМе»э»мәПәуөДИЬТәЦР(pH<7)Јәc(CH3COO-)>cCl-)>c(CH3COOH)>c(H+)
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘЈә2H2ЈЁgЈ©+O2ЈЁgЈ©ЁT2H2OЈЁlЈ© ЎчH= -571.6kJmol-1
2CH3OHЈЁlЈ©+3O2ЈЁgЈ©ЁT2CO2ЈЁgЈ©+4H2OЈЁlЈ© ЎчH= -1452kJmol-1
H+ЈЁaqЈ©+OH-ЈЁaqЈ©ЁTH2OЈЁlЈ© ЎчH= -57.3kJmol-1
ПВБРЛө·ЁХэИ·өДКЗ
A.H2ЈЁgЈ©өДИјЙХИИОӘ571.6kJmol-1
B.![]() H2SO4ЈЁaqЈ©+
H2SO4ЈЁaqЈ©+![]() BaЈЁOHЈ©2ЈЁaqЈ©ЁT
BaЈЁOHЈ©2ЈЁaqЈ©ЁT![]() BaSO4ЈЁsЈ©+H2OЈЁlЈ© ЎчH=-57.3kJmol-1
BaSO4ЈЁsЈ©+H2OЈЁlЈ© ЎчH=-57.3kJmol-1
C.Н¬ЦКБҝөДH2ЈЁgЈ©әНCH3OHЈЁlЈ©НкИ«ИјЙХЈ¬H2ЈЁgЈ©·ЕіцөДИИБҝ¶а
D.3H2ЈЁgЈ©+CO2ЈЁgЈ©ЁTCH3OHЈЁlЈ©+H2OЈЁlЈ© ЎчH=+131.4kJmol-1
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПхЛбожп§ЎўБЧЛбГМп§КЗБҪЦЦЦШТӘөДёҙСОЈ¬ФЪ№ӨЕ©ТөЙъІъЦРҫЯУР№г·әУҰУГЎЈ
(1) ёҙСОКЗУЙБҪЦЦ»тБҪЦЦТФЙПҪрКфАлЧУ(»тп§ёщАлЧУ)әНТ»ЦЦЛбёщАлЧУ№№іЙөДСОЎЈПВБРОпЦККфУЪёҙСОөДКЗ________(МоРтәЕ)ЎЈ
AЈ®BaFe2O4ЎЎЎЎBЈ®NaHSO4ЎЎЎЎCЈ®KAl(SO4)2ЎӨ12H2OЎЎЎЎDЈ®Ag (NH3)2OH
(2) ПхЛбожп§[(NH4)2Ce(NO3)6]өДЦЖұё·Ҫ·ЁИзПВЈә

ўЩЎ°Сх»ҜЎұөГөҪCeO2өД»ҜС§·ҪіМКҪОӘ________________________________ЎЈ
ўЪЦӨГчCeO2ТСҫӯПҙөУёЙҫ»өД·Ҫ·ЁКЗ_____________________________ЎЈ
(3) ОӘІв¶ЁБЧЛбГМп§[(NH4)aMnb(PO4)cЎӨxH2O]өДЧйіЙЈ¬ҪшРРИзПВКөСйЈәўЩіЖИЎСщЖ·2.448 0 gЈ¬јУЛ®ИЬҪвәуЕдіЙ100.00 mLИЬТәAЈ»ўЪБҝИЎ25.00 mLИЬТәAЈ¬јУЧгБҝNaOHИЬТәІўід·ЦјУИИЈ¬ЙъіЙNH3 0.067 20 L(ұкЧјЧҙҝц)Ј»ўЫБнИЎ25.00 mLИЬТәAЈ¬ұЯ№ДҝХЖшұЯ»әВэөОјУ°ұЛ®Ј¬ҝШЦЖИЬТәpH 6 Ў« 8Ј¬ід·Ц·ҙУҰәуЈ¬Ҫ«ИЬТәЦРMn2Ј«ЧӘ»ҜОӘMn3O4Ј¬өГMn3O4 0.2290 gЎЈНЁ№эјЖЛгИ·¶ЁёГСщЖ·өД»ҜС§КҪ(РҙіцјЖЛг№эіМ) __________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФУсГЧЈЁЦчТӘіЙ·ЦКЗөн·ЫЈ©ОӘФӯБПЦЖұёТТҙјөДБчіМИзПВ
![]()
ПВБРЛө·ЁІ»ХэИ·өДКЗЈЁ Ј©ЎЈ
A.C12H22O11КфУЪ¶юМЗB.1molЖПМСМЗҝЙ·ЦҪвіЙ3molТТҙј
C.ҝЙУГөвЛ®јмСйөн·ЫКЗ·сНкИ«Л®ҪвD.І»ДЬУГ·ЦТәІЩЧч·ЦАлТТҙјәНЛ®
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ»ҜәПОпAҫӯАоұИПЈ·ЁІвөГЖдЦРә¬МјөДЦКБҝ·ЦКэОӘ72.0%Ўўә¬ЗвөДЦКБҝ·ЦКэОӘ6.67%Ј¬ЖдУаОӘСхЈ¬ЦКЖЧ·Ё·ЦОцөГЦӘAөДПа¶Ф·ЦЧУЦКБҝОӘ150ЎЈПЦҙъТЗЖч·ЦОцУР»ъ»ҜәПОпөД·ЦЧУҪб№№УРТФПВБҪЦЦ·Ҫ·ЁЎЈ
·Ҫ·ЁТ»ЈәәЛҙЕ№ІХсТЗҝЙТФІв¶ЁУР»ъОп·ЦЧУАпІ»Н¬»ҜС§»·ҫіөДЗвФӯЧУј°ЖдПа¶ФКэБҝЈ¬ИзТТҙј(CH3CH2OH)өД1HәЛҙЕ№ІХсЖЧУР3ёц·еЈ¬Жд·еГж»эЦ®ұИОӘ3ЎГ2ЎГ1ЎЈПЦІвіцAөД1HәЛҙЕ№ІХсЖЧУР5ёц·еЈ¬Жд·еГж»эЦ®ұИОӘ1ЎГ2ЎГ2ЎГ2ЎГ3ЎЈ
·Ҫ·Ё¶юЈәАыУГәмНв№вЖЧТЗҝЙіхІҪјмІвУР»ъ»ҜәПОпЦРөДДіР©»щНЕЈ¬ПЦІвөГA·ЦЧУөДәмНв№вЖЧИзНјЛщКҫЎЈ
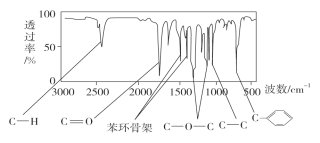
ТСЦӘЈәA·ЦЧУЦРЦ»ә¬Т»ёцұҪ»·Ј¬ЗТұҪ»·ЙПЦ»УРТ»ёцИЎҙъ»щЎЈКФ»ШҙрПВБРОКМвЈә
(1)AөД·ЦЧУКҪЈә________ЎЈ
(2)AөДҪб№№јтКҪЈә__________________(ИОРҙТ»ЦЦ)ЎЈ
(3)AөД·јПгАаН¬·ЦТм№№МеУР¶аЦЦЈ¬Зл°ҙТӘЗуРҙіцЖдҪб№№јтКҪЎЈ
ўЩ·ЦЧУЦРІ»ә¬јЧ»щөД·јПгЛбЈә_____________________Ј»
ўЪУцFeCl3ПФЧПЙ«ЗТұҪ»·ЙПЦ»УРБҪёцИЎҙъ»щөД·јПгИ©Јә________________(ИОРҙТ»ЦЦ)ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝNaNO2КЗТ»ЦЦ°ЧЙ«ТЧИЬУЪЛ®өД№ММеЈ¬ИЬТәіКјоРФЈ¬ЖдНв№ЫУлВИ»ҜДЖПаЛЖЈ¬УРПМО¶Ј¬ЛЧіЖ№ӨТөСОЈ»КЗТ» ЦЦЦШТӘөД»ҜС§КФјБЎўЖҜ°ЧјБәНКіЖ·МнјУјБЎЈТСЦӘСЗПхЛбСОДЬұ»деЛ®Сх»ҜЈ¬ФЪЛбРФМхјюПВДЬСх»ҜСЗМъАлЧУЈ» СЗПхЛбТшКЗҝЙИЬУЪПЎПхЛбөД°ЧЙ«іБөнЎЈ
ЗлНкіЙТФПВМоҝХЈә
ЈЁ1Ј©NФӯЧУЧоНвІгөзЧУөД№мөАЕЕІјКҪОӘ_______Ј»УГТ»ёцКВКөЛөГчөӘәНСх·ЗҪрКфЗҝИх_______ЎЈ
ЈЁ2Ј©ЛбРФМхјюПВЈ¬NaNO2ИЬТәЦ»ДЬҪ«IЈӯСх»ҜОӘI2Ј¬Н¬КұЙъіЙNOЎЈРҙіцҙЛ·ҙУҰўЩөДАлЧУ·ҪіМКҪІўұкіцөзЧУЧӘТЖөД·ҪПтәНКэДҝ______ЎЈ
ЈЁ3Ј©ВИЖшЎўЕЁПхЛбЎўЛбРФёЯГМЛбјШөИ¶јКЗіЈУГөДЗҝСх»ҜјБЈ¬№ӨТөЙПСх»ҜВұЛ®ЦРөДIЈӯМбИЎөҘЦКI2СЎФсБЛјЫёсІўІ»ұгТЛөДСЗПхЛбДЖЈ¬ҝЙДЬөДФӯТтКЗ_______ЎЈ
ЈЁ4Ј©ФЪСОЛбИЬТәЦРјУИлСЗПхЛбДЖИЬТәЦБЦРРФЈ¬Фтc(Cl-)_____c(HNO2)ЈЁМоЎ°<ЎұЎўЎ°>Ўұ»тЎ°=ЎұЈ©ЎЈ
ЈЁ5Ј©ЙијЖТ»ЦЦјшұрСЗПхЛбДЖәНВИ»ҜДЖөДКөСй·Ҫ°ёЎЈ_______
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝУл»ҜС§ЖҪәвАаЛЖЈ¬өзАлЖҪәвөДЖҪәвіЈКэЈ¬ҪРЧцөзАліЈКэЈЁУГkұнКҫЈ©.ПВұнКЗ25ЎжПВјёЦЦіЈјыИхЛбөДөзАлЖҪәвіЈКэЈә
Лб | өзАл·ҪіМКҪ | өзАлЖҪәвіЈКэK |
CH3COOH | CH3COOH | 1.96ЎБ10-5 |
HClO | HClO | 3.0ЎБ10-8 |
H2CO3 | H2CO3 HCO3- | K1=4.4ЎБ10-7 K2=5.6ЎБ10-11 |
H2SO3 | H2SO3 HSO3- | K1=1.54ЎБ10-2 K2= 1.02ЎБ10-7 |
»ШҙрПВБРОКМвЈә
ЈЁ1Ј©CH3COOHЎўHClOЎўH2CO3ЎўHCO3-ЎўH2SO3ЎўHSO3-¶јҝЙҝҙЧчКЗЛбЈ¬ЖдЦРЛбРФЧоЗҝөДКЗ_________Ј¬ЧоИхөДКЗ________________ЎЈ
ЈЁ2Ј©ПтNa2CO3ИЬТәЦРНЁИлЧгБҝөДВИЖшЈ¬·ўЙъөДАлЧУ·ҪіМКҪОӘ______________________Ј¬ПтNaClOИЬТәЦРНЁИлЙЩБҝөД¶юСх»ҜБтЈ¬·ўЙъөДАлЧУ·ҪіМКҪОӘ____________________________________ЎЈ
ЈЁ3Ј©Зу25ЎжКұЈ¬1.2mol/L өДNaClOИЬТәpH=____________ЈЁјәЦӘЈәlg2=0.3Ј©Ј¬0.10mol/LөДCH3COOHИЬТәЦРөДc(H+)=______________mol/LЎЈ
Ійҝҙҙр°ёәНҪвОц>>
°Щ¶ИЦВРЕ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com