
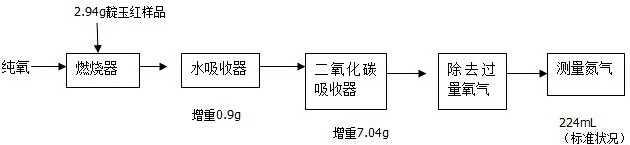
| m |
| M |
| V |
| Vm |
| 2.94g |
| 147g/mol |
| 0.224L |
| 22.4L/mol |
| 7.04g |
| 44g/mol |
| 0.16mol×12g/mol |
| 2.94g |
| 0.9g |
| 18g/mol |
| 0.64g |
| 16g/mol |


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
| ① |
| ④ |
| ② |
| ③ |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | G | H | I | |||||
| 3 | B | Mg | C | D | E | F |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | (11) | (12) |
查看答案和解析>>
科目:高中化学 来源: 题型:
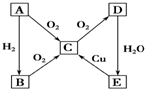 在通常状况下,A为固态单质.根据图转化关系,回答:
在通常状况下,A为固态单质.根据图转化关系,回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、各原子轨道电子均已填满 |
| B、其原子与同周期ⅠA、ⅡA族阳离子具有相同的核外电子排布 |
| C、化学性质非常不活泼 |
| D、同周期中第一电离能最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com