
| A. | SO2为0.4mol/L,O2为0.2mol/L | B. | SO2为0.15mol/L | ||
| C. | SO2,SO3均为0.25mol/L | D. | SO3为0.4mol/L |
分析 化学平衡研究的对象为可逆反应.化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析.
解答 解:A.SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度浓度变化分别为0.2mol/L、0.1mol/L,因可逆反应,实际变化应小于该值,所以SO2小于 0.4mol/L,O2小于0.2mol/L,故A错误;
B.SO2的浓度减小,说明反应向正反应方向进行建立平衡,SO2的浓度浓度小于0.2mol/L,大于0即可,该题中为0.15mol/L,小于0.2mol/L,故B正确;
C.反应物、生产物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误;
D.SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变化为0.2mol/L,实际变化应小于该值,故D错误;
故选B.
点评 本题考查了化学平衡的建立,难度不大,关键是利用可逆反应的不完全性,运用极限假设法解答,假设法是解化学习题的常用方法.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | Ki1的表达式为Ki1=$\frac{c({H}_{2}C{O}_{3})}{C({H}^{+})•C(HC{{O}_{3}}^{-})}$ | |
| B. | Ki2对应的电离过程是HCO3-+H2O≒H2CO3+OH- | |
| C. | 当碳酸的电离平衡正向移动时,Ki1与Ki2均相应增大 | |
| D. | 改变条件使Ki1减小,则Ki2一定也减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2有两性 | |
| B. | 两试管沉淀均是BaSO3 | |
| C. | SO2有还原性,酸性 | |
| D. | 升高PH,使SO2水溶液中SO32-浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
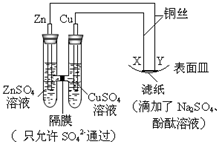
| A. | X为阴极,发生还原反应 | |
| B. | 电子沿Zn→Y→X→Cu路径流动 | |
| C. | Na+移向Y,与滤纸接触处有氧气生成 | |
| D. | Y与滤纸接触处变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定是甲烷和乙烯 | ||
| C. | 混合气体中可能有乙烷 | D. | 混合气体中可能有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过量NaOH溶液除去镁粉中的铝粉 | B. | AlCl3溶液和氨水制备Al(OH)3沉淀 | ||
| C. | 用盐酸和AgNO3溶液鉴定Cl- | D. | 用加热的方法鉴别Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| B. | 金属材料都是导体,非金属材料都是绝缘体 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 | |
| D. | 我国规定自2008年6月1日起,商家不得无偿提供塑料袋,目的是减少“白色污染” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com