
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
分析 (1)根据反应4NH3+3O2=2N2+6H2O可知氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极;氧气在正极得电子发生还原反应;
(2)①溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,由电荷守恒可知c(H+)<c(OH-),溶液呈碱性,结合选项根据反应物量的关系,判断溶液酸碱性;
②根据电荷守恒判断溶液中氢离子与氢氧根离子浓度的相对大小,进而判断溶液的酸碱性;溶液中存在平衡NH3•H2O?NH4++OH-,根据溶液的pH值计算溶液中c(OH-),根据氯离子浓度计算c(NH4+),利用物料守恒计算溶液中c(NH3•H2O),代入NH3•H2O的电离常数表达式计算;
(3)①化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积;温度升高K减小,所以正反应是放热反应;
②根据平衡常数和浓度商的相对大小分析解答;
(4)利用盖斯定律①-2×②可得氨高温催化氧化的热化学方程式.
解答 解:(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O,氨分子中氮元素的化合价升高,发生氧化反应,应通入燃料电池的负极;电解质溶液为KOH溶液,氧气在正极得电子发生还原反应,电极反应为O2+2H2O+4e-=4OH-,
故答案为:负极;O2+2H2O+4e-=4OH-;
(2)①溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,由电荷守恒可知c(H+)<c(OH-),溶液呈碱性,
a.盐酸不足,氨水剩余,为氯化铵与氨水的混合溶液,铵根离子水解程度小于氨水的电离时,溶液可能呈碱性,故a可能;
b.氨水与盐酸恰好完全反应,为氯化铵溶液,铵根离子水解,溶液呈酸性,故b不可能;
c.盐酸过量,溶液为氯化铵、盐酸的混合溶液,溶液呈酸性,故c不可能;
故答案为:a;
②根据电荷守恒有c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)=c(Cl-),故c(H+)=c(OH-),溶液呈中性,故溶液中c(OH-)=10-7mol/L,溶液中c(NH4+)=c(Cl-)=$\frac{1}{2}$×0.1mol•L-1=0.05mol•L-1,故混合后溶液中c(NH3•H2O)=$\frac{1}{2}$×amol•L-1-0.05mol•L-1=(0.5a-0.05)mol/L,NH3•H2O的电离常数Ka=$\frac{c(O{H}^{-})•c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×0.05}{0.5a-0.05}$=$\frac{1{0}^{-8}}{a-0.1}$,
故答案为:$\frac{1{0}^{-8}}{a-0.1}$;
(3)①化学平衡常数等于平衡时生成物浓度幂之积比上反应物浓度幂之积,则K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;温度升高K减小,所以正反应是放热反应,所以b<0,故答案为:K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$;小于;
②400℃时,某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时Qc=$\frac{(\frac{3mol}{0.5L})^{2}}{\frac{2mol}{0.5L}×(\frac{1mol}{0.5L})^{3}}$=1.125>K=0.5,所以平衡逆向移动,则v正(N2)<v逆(N2),
故答案为:小于;
(4)已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ/mol
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
利用盖斯定律①-2×②可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
点评 本题考查电极反应式的书写、电解质溶液中平衡常数的计算、化学平衡常数表达式的书写、平衡的移动、热化学方程式的计算等知识,难度中等,综合性较强.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:填空题
| 元素符号 | 原子结构和元素性质 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大 |
| N | 原子序数比T小,且与T同主族 |
| X | 最外层电子数是次外层的2倍 |
| Y | 常见单质为双原子分子且氢化物的水溶液呈碱性 |
| Z | 元素最高价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示.该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动.| A. | 电极a的反应式为:CH4+4O2--8e-=CO2+2H2O | |
| B. | 电极b是正极,O2-由电极a流向电极b | |
| C. | 瓦斯分析仪工作时,电池内电路中电子由电极 a流向电极b | |
| D. | 当固体电解质中有2 mol O2-通过时,外电路通过电子8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取金属锰 | |
| B. |  制取二氧化碳 | |
| C. |  蒸发饱和食盐水制取食盐晶体 | |
| D. |  验证FeCl3对H2O2分解反应有催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
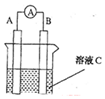 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com