

| A. | 碳表面发生氧化反应 | |
| B. | 钢铁被腐蚀的最终产物为FeO | |
| C. | 生活中钢铁制品的腐蚀以图①所示为主 | |
| D. | 图②中,正极反应式为O2+4e-+2H2O═4OH- |
分析 A.碳为正极,发生还原反应;
B.钢铁被腐蚀的最终产物为Fe2O3;
C.钢铁制品的腐蚀以吸氧腐蚀为主;
D.吸氧腐蚀的正极上氧气得电子生成氢氧根离子.
解答 解:A.碳为正极,正极上氢离子或氧气得电子发生还原反应,故A错误;
B.钢铁被腐蚀生成亚铁离子,亚铁离子与氢氧根离子反应生成氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁,然后氢氧化铁分解为Fe2O3,故B错误;
C.钢铁制品的腐蚀以吸氧腐蚀为主,图中①为析氢腐蚀,图②为吸氧腐蚀,所以以图②所示为主,故C错误;
D.图②中为吸氧腐蚀,正极上氧气得电子生成氢氧根离子,其正极反应式为O2+4e-+2H2O═4OH-,故D正确.
故选D.
点评 本题考查钢铁的析氢腐蚀,明确析氢腐蚀及吸氧腐蚀区别是解本题关键,知道钢铁发生析氢腐蚀及吸氧腐蚀的条件,会正确书写各个电极上电极反应式,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3与O2起始时物质的量之比等于4:5,则平衡后两物质的转化率一定相等 | |
| B. | 平衡时4v正(O2)=5v逆(NO) | |
| C. | 平衡后降压,混合气体平均摩尔质量减小 | |
| D. | 达到平衡时放出热量为905.9 kJ,则起始时投入4mol NH3和5mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水的电离平衡曲线如图所示:
水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硝酸具有强氧化性,遇铁铝发生钝化,可用A1、Fe制容器储存、运输浓硝酸 | |
| B. | 晶体硅具有半导体性质,可用于生产光导纤维 | |
| C. | 二氧化硫有漂白性,可用于加工食品使食品增白 | |
| D. | Fe3+具有氧化性,可用于净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时,如果加水超过了刻度线,则可用胶头滴管吸出多余部分 | |
| B. | 蒸馏时,应将温度计水银球置于蒸馏烧瓶支管口处 | |
| C. | 分液时,下层液体从分液漏斗下口流出,上层液体应从分液漏斗上口倒出 | |
| D. | 称量NaOH 时,NaOH 置于小烧杯中放在托盘天平左盘,砝码放在右盘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入氨水,产生白色沉淀,证明原溶液中存在Al3+ | |
| B. | 向某溶液中加入NaOH并加热,产生可使湿润红色石蕊试纸变蓝的气体,则原溶液中有NH4+ | |
| C. | 向某溶液中加入Ba(NO3)2溶液,产生白色沉淀,加入稀硝酸沉淀不溶解,则原溶液中有SO42- | |
| D. | 向某溶液中加入AgNO3溶液,产生白色沉淀,则原溶液中有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
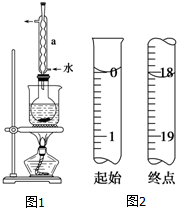 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com