
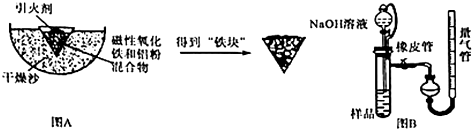
分析 (1)浓硫酸具有脱水性,并放出热;
(2)Al还原Fe3O4生成Fe和Al2O3,结合质量守恒定律分析;
(3)滴入足量NaOH溶液充分反应,测量生成气休体积以测量样品中残留铝的百分含量,由图可知,量气管测定氢气的体积,读数时调节内外液面相平,可利用滴定管代替量气管,结合2Al+2NaOH+2H2O=2NaAlO2+3H2↑计算含量,如果装置没有橡胶管,烧瓶内压强增大,造成气体读数偏大,以此来解答.
解答 解:(1)因为把浓硫酸加入到蔗糖中发生脱水并放出大量的热,可作引火剂,故答案为:蔗糖在浓硫酸中脱水并放出大量的热;
(2)Al还原Fe3O4生成Fe和Al2O3,由原子守恒可得化学方程式为8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe,故答案为:8Al+3Fe3O4$\frac{\underline{\;高温\;}}{\;}$4Al2O3+9Fe;
(3)滴入足量NaOH溶液充分反应,测量生成气休体积以测量样品中残留铝的百分含量,由图可知,量气管测定氢气的体积,
①因为该仪器盛放NaOH溶液,所以由碱式滴定管改装而成,故答案为:碱式滴定管;
②因为气体的体积受温度和压强影响,所以量气管在读数时必须进行的步骤是:冷却至常温和调节量气管使左右液面相平,故答案为:冷却至常温和调节量气管使左右液面相平;
③根据Al与NaOH溶液反应的化学方程式:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,m(Al)=n(Al)×27g/mol=$\frac{2}{3}$3n(H2)×27g/mol=$\frac{2}{3}$×0.0448L÷22.4L/mol×27g/mol=0.036g,则铝的百分含量为$\frac{0.036g}{1g}$×100%=3.6%,故答案为:3.6%;
④如果装置没有橡胶管,烧瓶内压强增大,造成气体读数偏大,则铝的百分含量将会偏大,故答案为:偏大.
点评 本题以铝热反应为载体考查物质含量测定,为高频考点,把握反应原理、气体的测定装置为解答的关键,侧重分析与计算、实验能力的综合考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe的基态原子外围电子排布图: | |
| B. | 氯化钠的分子式:NaCl | |
| C. | N的基态原子核外电子排布式:lS22S22p3 | |
| D. | HC10的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
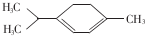 青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )
青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有(不含立体异构)( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 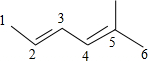 :5-甲基-2,4-己二烯 :5-甲基-2,4-己二烯 | B. |  1,2,3,4-四甲基环己烷 1,2,3,4-四甲基环己烷 | ||
| C. |  :1,3,4-三甲基苯 :1,3,4-三甲基苯 | D. | 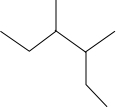 :3-甲基-2-乙基戊烷 :3-甲基-2-乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 投料比 CO的体积分数% 温度/℃ | $\frac{n({H}_{2}O)}{n(CO)}$=1 | $\frac{n({H}_{2}O)}{n(CO)}$=3 | $\frac{n({H}_{2}O)}{n(CO)}$=5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.125 | B. | 0.10 | C. | 0.08 | D. | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com