
【题目】在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)![]() N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③B.③和⑤
C.④和⑤D.②和④
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法不正确的是![]()
A.“酸雨”、“臭氧层受损”、“光化学烟雾”都与氮氧化物有关
B.PM2.5作为空气质量预报的一项重要指标,它是指空气中直径小于或等于2.5m的颗粒物,该值越高,代表空气污染程度越严重
C.静电除尘治理悬浮颗粒污染,其依据是胶体的电泳原理
D.为消除碘缺乏症,卫生部规定食盐中必须加含碘物质,食盐中所加含碘物质是KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
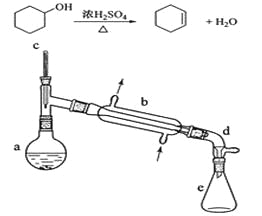
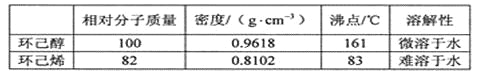
可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是__________________。
(2)加入碎瓷片的作用是_______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时_____________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为_______________________。
(4)分液漏斗在使用前须清洗干净并____________;在本实验分离过程中,产物应该从分液漏斗的_________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有___________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是____________(填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________。
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成,丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉。羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3的空间构型为_______;
(5)“NiO”晶胞如图:
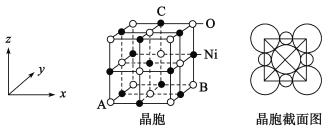
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________;
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)。(Ni的相对于原子质量是59)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般来说,对一种未知有机物结构的测定主要包括以下几个方面:
①确定相对分子质量;
②测定元素组成(种类和比例);
③研究该有机物的各种性质;
④确定结构。
(1)相对分子质量的确定一般利用质谱法,蒸气密度法等。某有机物![]() 的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取
的质谱图显示其相对分子质量最大是72。组成元素的测定常采用元素分析仪,也可采用燃烧法。称取![]()
![]() ,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加
,在足量氧气中充分燃烧,生成物通过浓硫酸后,浓硫酸的质量增加![]() ,剩余气体通过碱石灰,碱石灰的质量增加
,剩余气体通过碱石灰,碱石灰的质量增加![]() ,则
,则![]() 的分子式为______。
的分子式为______。
(2)核磁共振谱常用氢谱或碳谱,它主要测定分子中具有不同特点的![]() 或
或![]() 的种类与比例。如对于有机物
的种类与比例。如对于有机物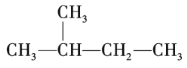 ,其
,其![]() 谱有四个峰,峰高比为
谱有四个峰,峰高比为![]() ;
;![]() 谱有四个峰,峰高比为
谱有四个峰,峰高比为![]() 。有机物
。有机物![]() 的
的![]() 谱有两个峰,峰高比为
谱有两个峰,峰高比为![]() ,氢谱有一个峰。试写出有机物
,氢谱有一个峰。试写出有机物![]() 的结构简式:______。
的结构简式:______。
(3)![]() 的一氯代物有______种,二氯代物有______种。
的一氯代物有______种,二氯代物有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中正确的是

A. a极要与Y极连接
B. N电极发生还原反应,当N电极消耗5.6L(标准状况下)气体时,则a电极增重64g
C. 不论b为何种电极材料,b极的电极反应式一定为2C1--2e-=Cl2↑
D. 若有机废水中主要含有乙醛,则图甲中M极发生的电极应为:CH3CHO+3H2O-l0e-=2CO2↑+l0H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
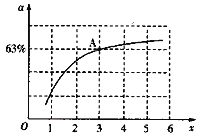
②已知原料气中的氨碳比[![]() ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大,![]() 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在等体积①pH=1的硫酸;②0.01mol·L-1NaOH溶液;③pH =10的纯碱溶液中;水电离程度的大小顺序是( )
A.①>②>③B.②>①>③C.③>①>②D.③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握化学的基本概念和研究方法才能学好化学。按要求回答下列问题:
(1)下列是对碱、酸、盐、氧化物的分类列表:
碱 | 酸 | 盐 | 氧化物 | |
第一组 |
|
|
|
|
第二组 |
|
|
|
|
第三组 |
|
|
|
|
表中每组均有物质分类错误,三组中对应分类错误的物质分别是_________、_________、_________。(填化学式)
(2)![]() 固体不能导电,而
固体不能导电,而![]() 溶液可以导电,原因是_________________________。
溶液可以导电,原因是_________________________。
(3)依据下列两个反应,按要求填空。
Ⅰ.![]()
Ⅱ.![]()
反应Ⅰ和反应Ⅱ中,![]() 只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下
只作氧化剂的反应是________(填“Ⅰ”或“Ⅱ”);反应Ⅱ中,每生成标准状况下![]() ,反应中转移________
,反应中转移________![]() 电子;
电子;![]() 和
和![]() 都能使澄清石灰水变浑浊,请设计一种方法检验
都能使澄清石灰水变浑浊,请设计一种方法检验![]() 、
、![]() 混合气体中的
混合气体中的![]() :_____________。
:_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com