
| A. | 离子化合物中都含有离子键 | |
| B. | 离子化合物中的阳离子只能是金属离子 | |
| C. | 有些离子化合物可能含有共价键 | |
| D. | 溶于水可以导电的化合物一定是离子化合物 |
分析 A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
B.离子化合物中阳离子可能不是金属离子;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键;
D.溶于水可以导电的化合物可能是离子化合物也可能是共价化合物.
解答 解:A.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,所以离子化合物中都含有离子键,故A正确;
B.离子化合物中阳离子可能不是金属离子,如铵盐,故B错误;
C.含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,如KOH等,故C正确;
D.溶于水可以导电的化合物可能是离子化合物也可能是共价化合物,如硫酸等共价化合物,故D错误;
故选BD.
点评 本题考查化学键和化合物的关系,侧重考查基本概念,明确物质构成微粒及微粒之间存在作用力是解本题关键,注意规律中的特殊现象,易错选项是B.


科目:高中化学 来源: 题型:选择题
| A. | H2SO4→MgSO4 | B. | NaCl→Cl2 | C. | CuSO4→Cu | D. | HClO→Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用溴水或酸性KMnO4溶液鉴别甲烷和乙烯 | |
| B. | 向酒精中加入足量生石灰检验酒精中是否含有少量水 | |
| C. | 在盛有2mL无水乙醇的试管中放入绕成螺旋状的光洁铜丝,加热可制得乙醛 | |
| D. | 将裂解气通入到酸性KMnO4溶液中来证明裂解气中是否有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CHCl3是三角锥形 | |
| B. | 凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 | |
| C. | AB2是V形,其A可能为sp2杂化 | |
| D. | NH4+是平面四边形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
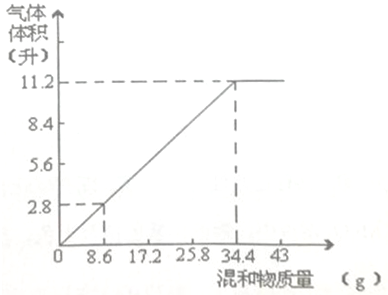 加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.
加热碳酸铵[(NH4)2CO3】并使产物全部变成气态.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2~4 s内的平均反应速率为0.2 mol•L-1•s-1 | |
| B. | 前4 s内的平均反应速率为0.3 mol•L-1•s-1 | |
| C. | 前2 s内的平均反应速率为0.4 mol•L-1•s-1 | |
| D. | 2 s末的反应速率为0.4 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.
以铬铁矿(主要成分FeO•Cr2O3,含有少量SiO2等)为原料制取铬酸钠晶体(Na2CrO4)工艺流程如图所示.| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.6 | |
| 沉淀完全的pH | 3.7 | 9.6 | 9(>9)溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com