
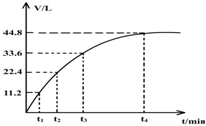
 向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L.若将该混合物加入500ml15mol•L-的浓HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体.( )| A. | t1 | B. | t2 | C. | t3 | D. | t4 |
分析 根据金属和稀盐酸的反应计算金属的物质的量,再根据金属和硝酸反应时需要最多硝酸的物质的量,结合题给硝酸的物质的量确定金属是否完全反应,再结合转移电子守恒计算NO和NO2的体积,从而确定选项.
解答 解:设Al、Fe的物质的量分别是xmol、ymol
27x+56y=44.4
1.5x+y=$\frac{26.88L}{22.4L/mol}$
解得x=0.4 y=0.6
所以Al、Fe的物质的量分别是0.4mol、0.6mol,
Al、Fe和硝酸反应生成盐和氮氧化物时,当完全都生成NO2时,需要硝酸的物质的量最多,最多需要硝酸的物质的量为金属物质的量的6倍,所以最多需要硝酸6mol,实际上n(HNO3)=15mol/L×0.5L=7.5mol>6mol,所以硝酸有剩余,则Fe转化为Fe3+,
设NO的物质的量为a、NO2的物质的量为b,
根据转移电子相等得
a+b=$\frac{44.8}{22.4}$
3a+b=3
解得a=0.5 b=1.5,
所以NO2的物质的量为1.5mol,其体积=22.4L/mol×1.5mol=33.6L,则从33.6L开始生成NO,故选C.
点评 本题考查混合物计算、氧化还原反应计算,金属与盐酸反应数据为干扰信息,容易导致问题复杂,注意利用守恒思想进行解答,侧重解题方法与学生分析解决问题能力的考查,难度中等.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 调味剂和着色剂是食品添加剂,添加量越多越好 | |
| B. | 蔬菜、水果富含膳食纤维,适量摄入有利人体健康 | |
| C. | 维生素c在人体内有重要功能,维生素c不溶于水 | |
| D. | 钾是人体必需的微量元素,食盐的主要成分是KCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y元素的主族序数之差为1 | |
| B. | 若X+、Y2-相差两个电子层,则X2Y可能是离子化合物也可能是共价化合物 | |
| C. | 若X+、Y2-核外电子数相差8,则原子半径Y>X | |
| D. | 若X+、Y2-具有相同的电子层结构,则离子半径X+>Y2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变反应条件可以改变该反应的限度 | |
| B. | 达到平衡后,SO3、SO2、O2在密闭容器中共存 | |
| C. | 达到平衡后,反应停止,正、逆反应速率都等于零 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中的乙酸,用饱和碳酸钠水溶液洗涤后分液 | |
| B. | 用燃烧的方法可以鉴别乙醇、苯和四氯化碳 | |
| C. | 要除去甲烷中的乙烯,可选用溴水 | |
| D. | 甲烷和氯气按体积比1:3混合,可制得纯净的CHCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原单烯烃只可能有3种不同结构 | |
| B. | 该产物的名称是1,1-二甲基丙烷 | |
| C. | 1mol加成产物燃烧消耗6.5mol氧气 | |
| D. | 原烯烃与分子式是C3H6的烃一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 上述氧化物都是酸性氧化物 | |
| B. | 该反应中NOx用作氧化剂,发生还原反应 | |
| C. | 当x=2时,每生成1molN2,转移电子数为4mol | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com