
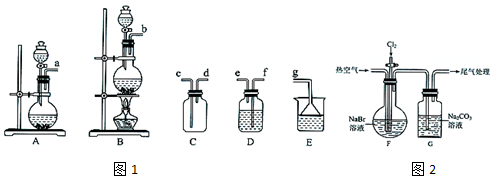
| 操作步骤 | 实验现象 | 结论或解释 |
| ①去适量G中溶液于试管中,加入硫酸酸化 | 产生气泡 | G中溶液含有CO32-或HCO3- |
| 向①的试管中加入CCl4,振荡,静置 | ②溶液分层,下层为棕红色 | 生成单质溴 |
分析 (1)①实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成;
②生成氯气含氯化氢和水蒸气,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(2)对G中溶液为碳酸钠吸收溴单质的反应,3Br2+3CO32-═5Br-+BrO3-+3CO2,取适量G中溶液于试管中加入硫酸酸化,若生成气体证明G中溶液含有CO32-或HCO3-,同时发生反应生成溴单质,向①的试管中加入CCl4,振荡,静置会出现分层现象,下层四氯化碳层萃取溴单质呈棕红色;
(3)工业上通常是将G中溶液运输到目的地后再酸化生成溴单质,是因为溴单质具有强腐蚀性,除去工业Br2中微量的Cl2,能和氯气反应且不与溴单质反应.
解答 解:(1)①实验室制备氯气是利用二氧化锰和浓盐酸加热反应生成,选择装置B,反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:B;MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
②生成氯气含氯化氢和水蒸气,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,欲收集一瓶纯净干燥的Cl2,选择图中装置,其连接顺序为:发生装置b→f→e→f→e→c→d→g,
故答案为:f→e→f→e→c→d→g;
(2)对G中溶液为碳酸钠吸收溴单质的反应,3Br2+3CO32-═5Br-+BrO3-+3CO2,取适量G中溶液于试管中加入硫酸酸化,若生成气体证明G中溶液含有CO32-或HCO3-,同时发生反应生成溴单质,5Br-+BrO3-+6H+=3Br2+3H2O,向①的试管中加入CCl4,振荡,静置会出现分层现象,下层四氯化碳层萃取溴单质呈棕红色,
故答案为:硫酸酸化;溶液分层,下层为棕红色;5Br-+BrO3-+6H+=3Br2+3H2O;
(3)工业上通常是将G中溶液运输到目的地后再酸化,主要是因为溴单质具有强腐蚀性,除去工业Br2中微量的Cl2,可向工业Br2中加入a.HBr,C.NaBr,氯气发生反应生成溴单质,不引入杂质,b.Na2CO3,d.Na2SO3,和溴单质、氯气都发生反应,故不选,
故答案为:溴单质具有强腐蚀性;ac.
点评 本题考查了海水的资源利用和提取、物质性质分析判断、气体制备和除杂等,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ba(HCO3)2、Al(NO3)3 | B. | CaCl2、NaHCO3 | C. | Al2(SO4)3、NaOH | D. | Na2CO3、CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
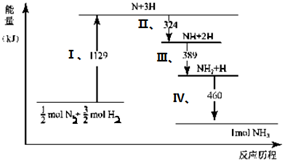
| A. | Ⅰ中1129 kJ为该反应过程的活化能 | |
| B. | N2(g)+3H2 (g)?2NH3 (g)△H=2(324+389+460-1129)kJ/mol | |
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | |
| D. | N2(g)+3H2 (g)?2NH3 (g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 水 | Na2CO3 | 混合前温度 | 混合后温度 |
| 35mL | 3.2g | 20℃ | 24.3℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
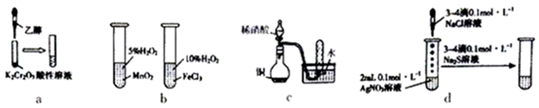
| A. | a图,滴加乙醇,试管中橙色溶液变为绿色,乙醇发生取代反应生成乙酸 | |
| B. | b图,左边试管中产生气泡迅速,说明二氧化锰的催化效果比氯化铁好 | |
| C. | c图,根据试管中收集到无色气体,能验证铜与稀硝酸的反应产物是NO | |
| D. | d图,试管中先有白色沉淀,后有黑色沉淀生成,能确定Ksp(AgCl)>Ksp(Ag2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的分子模型可表示为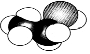 | |
| B. | 糖类、油脂、蛋自质都是高分子化合物 | |
| C. | 乙烯使溴的四氯化碳溶液褪色是因为发生了加成反应 | |
| D. | 炒菜时加酒和醋能使菜味香可口,原因是有酯类物质生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com