
【题目】Ⅰ:已知亚磷酸![]() 是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
是具有强还原性的二元弱酸,可被银离子氧化为磷酸。
(1)亚磷酸与银离子反应的离子方程式为_______________________。
(2)向亚磷酸溶液中滴加氢氧化钠溶液至中性,写出所得溶液中电荷守恒方程式_________________。
(3)某温度下,![]() 的亚磷酸溶液的pH为1.4,即
的亚磷酸溶液的pH为1.4,即![]() ,则该温度下亚磷酸的一级电离平衡常数
,则该温度下亚磷酸的一级电离平衡常数![]() _________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
_________。(亚磷酸第二级电离忽略不计,结果保留两位有效数字)
Ⅱ:焦亚硫酸钠![]() 在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
在医药、印染、食品等方面应用广泛,也可作为食品的抗氧化剂。
(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,写出该反应的化学方程式:__________________________。
(5)由于![]() 具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中
具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中![]() 的残留量时,取40mL葡萄酒样品,用
的残留量时,取40mL葡萄酒样品,用![]() 的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中
的含有淀粉的碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为_________________,该样品中![]() 的残留量为___________
的残留量为___________ ![]() (以
(以![]() 计)。
计)。
【答案】![]()
![]() ,加上
,加上![]() 、
、![]() 也可 0.0094
也可 0.0094 ![]() 当加入最后一滴标准液时,溶液恰好由无色变为蓝色,且半分钟不恢复 0.16
当加入最后一滴标准液时,溶液恰好由无色变为蓝色,且半分钟不恢复 0.16
【解析】
Ⅰ:(1)亚磷酸与银离子反应时,P元素化合价由+3价变为+5价、Ag元素由+1价变为0价,根据转移电子守恒配平方程式;
(2)溶液呈中性,则c(OH-)=c(H+),溶液中存在电荷守恒。
(3)其电离程度较小,所以溶液中c(H2PO3-)≈c(H+)=3.9×10-2mol·L-1,c(H3PO3)≈0.20mol·L-1,代入电离平衡常数表达式计算;
Ⅱ:(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2。
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2。
(5)滴定终点的现象为溶液恰好由无色变为蓝色,且半分钟不恢复;由题意知![]() ,由此计算。
,由此计算。
Ⅰ:(1)亚磷酸是二元弱酸,与银离子反应的离子方程式为:![]() 。
。
(2)中性时,![]() ,所以电荷守恒方程式为c(Na+)=c(H2PO3-)+2c(HPO32-),加上
,所以电荷守恒方程式为c(Na+)=c(H2PO3-)+2c(HPO32-),加上![]() 、
、![]() 也可。
也可。
(3)其电离程度较小,所以溶液中c(H2PO3-)≈c(H+)=3.9×10-2mol·L-1,c(H3PO3)≈0.20mol·L-1,代入电离平衡常数表达式计算,![]() 。
。
Ⅱ:(4)工业上制备焦亚硫酸钠![]() 常用
常用![]() 与碳酸钠溶液的反应,当
与碳酸钠溶液的反应,当![]() 加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2,反应方程式为:
加过量直至过饱和时,溶液中就会析出焦亚硫酸钠的晶体,同时生成CO2,反应方程式为:![]() ;
;
(5)滴定终点的现象为溶液恰好由无色变为蓝色,且半分钟不恢复;由题意知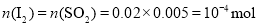 ,故
,故![]() 的残留量为:
的残留量为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,A是氯气发生装置,C、D 为气体净化装置(C中装有饱和食盐水;D 中装有浓硫酸),E 是硬质玻璃管装有细铁丝网,F为干燥的空广口瓶,烧杯G 中装有氢氧化钠溶液。
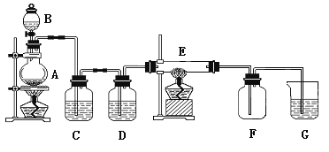
试回答:
(1)实验室制氯气的化学方程式:_______________________________;
(2)C装置的作用是________________;D 装置的作用是__________________;E中发生化学反应的方程式为:_____________________________。
(3)烧杯G 中装有氢氧化钠溶液的作用是___________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2 广泛用于造纸工业、污水处理等。工业上生产NaClO2 的工艺流程如下:

ClO2发生器中的反应为SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4
(1)NaClO3中Cl的化合价_______,上述反应中氧化剂是_______ ,被氧化的元素为_______。请用双线桥法表示该反应中电子转移的方向和数目SO2 + 2NaClO3 + H2SO4 = 2ClO2↑+ 2NaHSO4_______________________反应后,若产生0.6 mol气体,则电子转移的物质的量为 _______mol。
(2)吸收器中反应温度不能高于5℃的可能原因有 _______
(3)反应结束后,向ClO2发生器中通入一定量空气的目的是_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题
(1)质子数为17、中子数为20的原子可表示为________,Na+的结构示意图________。
(2)焰色反应是_______变化,将碳酸钠进行焰色反应,火焰呈________。
(3)漂白粉有效成分的化学式________,漂白粉发挥漂白作用的反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物的种类非常丰富,请回答下列问题:
(1)已知:![]()
![]()
![]()
![]() 则
则![]()
![]() _____________。
_____________。
(2)![]() 温度时在容积为2L的恒容密闭容器中充入
温度时在容积为2L的恒容密闭容器中充入![]() 和
和![]() 发生反应:
发生反应:![]() ,
,![]() ,
,![]() 时达到平衡,此时
时达到平衡,此时![]() 转化率为80%,
转化率为80%,
①![]() 内该反应的平均速率
内该反应的平均速率![]() _____________;
_____________;
②![]() 温度时该反应的化学平衡常数
温度时该反应的化学平衡常数![]() ___________;
___________;
③若不改变外界条件,向平衡后的容器中再通入![]() ,重新达到平衡后,
,重新达到平衡后,![]() 在体系中的百分含量_____________。(填“变大”“变小”或“不变”)
在体系中的百分含量_____________。(填“变大”“变小”或“不变”)
(3)工业合成氨的反应原理为:![]() ,
,![]() 。对于该反应,既可以提高平衡体系中
。对于该反应,既可以提高平衡体系中![]() 的百分含量,又能加快反应速率的措施是(______)(填序号)
的百分含量,又能加快反应速率的措施是(______)(填序号)
a.升高温度 b.将平衡体系中的氨气分离出来 c.增大体系压强 d.加入合适的催化剂
(4)如图所示,![]() 温度时,
温度时,![]() 和
和![]() 的投料比与平衡时
的投料比与平衡时![]() 体积分数的关系。(不考虑
体积分数的关系。(不考虑![]() 与
与![]() 之间的相互转化)
之间的相互转化)

横坐标代表![]() 和
和![]() 的投料比,纵坐标代表平衡时
的投料比,纵坐标代表平衡时![]() 体积分数,计算最高点
体积分数,计算最高点![]() 时
时![]() 的平衡体积分数为_____________。
的平衡体积分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质的焰色反应都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成C的溶液,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D。
(1)写出下列物质的化学式:B____________,E_____________。
(2)写出A→C的化学方程式,并标出电子转移的方向和数目:_______________
(3)写出C→D的离子方程式:________________________________。
(4)写出E→D的化学方程式:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示.有关该物质的说法中正确的是
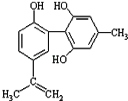
A.该物质与苯酚属于同系物,遇FeCl3溶液呈紫色
B.滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
C.该分子中的所有碳原子不可能共平面
D.1mol此物质分别与浓溴水和H2反应时最多消耗Br2和H2为4mol和7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.1NA
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1NA
C. 0.1molH2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D. 标准状况下,11.2LCH2Cl2中含有质子数为21.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸亚铬水合物[Cr(CH3COO)2]22H2O部分信息如下:
物理性质 | 化学性质 |
红棕色晶体,微溶于乙醇,难溶于冷水和乙醚(易挥发的有机溶剂) | 具有强还原性,易被氧化 |
制备原理:2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O(s)。
某兴趣小组设计实验制备[Cr(CH3COO)2]22H2O(s)。

回答下列问题:
(1)仪器A的名称是_____。
(2)检查装置B气密性的操作方法是_____。
(3)加入盐酸后,关闭K1,打开K2,将装置B中的导管抽出液面以上一段时间,目的是____。反应开始后,从装置B中看到的现象是溶液由深绿色(Cr3+)变为亮蓝色(Cr2+),且有气泡产生。写出装置B中发生的非置换反应的离子方程式:_____。
(4)当氢气的放出速率较快时,为了使装置B中溶液进入装置C中,宜采取的操作是_____;装置D中导管口水封的目的是_____。
(5)将装置C中所得产品提纯,其操作依次为过滤、去氧水洗涤、乙醚洗涤。相对乙醇或水,用乙醚洗涤的优点有______。
(6)测定产品纯度:取ag产品溶于蒸馏水,通入足量空气,充分反应后,加入过量氢氧化钠溶液,过滤、洗涤、灼烧、称重。得Cr2O3质量为mg(假设杂质不参与反应),[Cr(CH3COO)2]22H2O(s)的摩尔质量为Mg·mol-1。测得产品纯度为____ %。(用含a、m、M的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com