
| A. | NaOH的碱性比LiOH的弱 | |
| B. | HCl、HBr、HI的热稳定性依次增强 | |
| C. | HClO4的酸性比H2SO4强说明氯元素的非金属性比硫元素强 | |
| D. | 若M+和R2-的核外电子层结构相同,则原子序数:M>R |
分析 A.金属元素的金属性越强,其最高价氧化物对应水化物的碱性越强;
B.非金属元素的非金属性越强,其气态氢化物越稳定;
C.非金属的最高价氧化物对应水化物的酸性越强,非金属性越强;
D.根据质子数与核外电子数和离子所带电荷的关系判断.
解答 解:A.金属性Na>Li,其最高价氧化物对应水化物的碱性NaOH>LiOH,故A错误;
B.非金属性Cl>Br>I,气态氢化物的稳定性HCl>HBr>HI,故B错误;
C.HClO4的酸性比H2SO4的强,则非金属性Cl>S,故C正确;
D.M+和R2-的核外电子层结构相同,则M原子序数比R的大3,故D正确;
故选CD.
点评 本题综合考查元素周期律的递变规律,题目难度不大,掌握金属性和非金属性强弱的判定依据是解题的关键.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 钢铁发生析氢腐蚀的正极反应:2H++2e-═H2↑ | |
| B. | 钢铁发生吸氧腐蚀的负极反应:Fe-3e-═Fe3+ | |
| C. | 自行车的钢圈上镀一层铬,防止生锈 | |
| D. | 外加直流电源保护钢闸门时,钢闸门与直流电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只有①② | B. | 只有③⑤ | C. | 只有①②③ | D. | 只有①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、K+、SO42-、OH- | B. | Ba2+、K+、Cl-、CO32- | ||
| C. | Cu2+、Ba2+、Cl-、NO3- | D. | Fe2+、H+、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.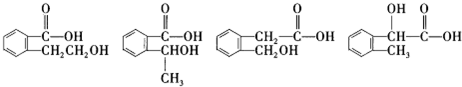 (任写两种).
(任写两种).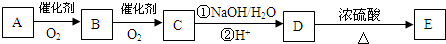
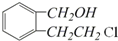 .
.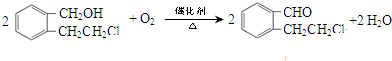 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体粒子带电荷并且在一定条件下能稳定存在Ba2+,Cu2+,Ag+溶液沉淀1溶液沉淀3+C+B+A沉淀2 | |
| B. | 胶体的分散质粒子直径在1 nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com