
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的最外层电子数是最内层电子数的3倍。下列判断正确的是
![]()
A. 原子半径:r(W)>r(Z)>r(Y)>r(X)
B. Y元素的单质只能跟酸反应,不能跟碱反应
C. 最简单气态氢化物的热稳定性:W>Z
D. W元素的各种氧化物对应的水化物均为强酸
科目:高中化学 来源: 题型:
【题目】为了验证木炭可被浓硫酸氧化成CO2,选用如图所示装置(内含物质)进行实验。

(1)如按气流由左向右的流向,连接如图所示装置的正确顺序是_______(填字母)
(2)若实验检验出有CO2生成,则装置乙、丙中的现象分别为装置乙中______,装置丙中________。
(3)装置丁中酸性KMnO4溶液的作用是________。
(4)写出装置甲中所发生反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
Ⅰ.CO可用于高炉炼铁,已知
Fe3O4(s)+4CO(g)====3Fe(s)+4CO2 △H1=akJ/mol
3Fe2O3(s)+ CO(g)====2Fe3O4(s)+CO2(g) △H2=bkJ/mol
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H3=___________kJ/mol(用含a、b的代数式表示)
Ⅱ.光气(COCl2)在塑料、制革、制药等工业中有许多用途。工业上常利用废气CO2通过反应:C(s)+CO2(g)![]() 2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:
2CO(g) △H>0,制取合成光气的原料气CO。在体积可变的恒压(pa)密闭容器中充入1 mol CO2与足量的碳发生上述反应,在平衡时体系中气体体积分数与温度的关系如图所示:

(1)①T℃时,在容器中若充入稀有气体,平衡___________移动(填“正向”“逆向”或“不”,下同);若充入等体积的CO2和CO,平衡___________移动。
②CO体积分数为80%时,CO2的转化率为___________。
③已知:气体分压(p分)=气体总压×体积分数。T℃时用平衡分压代替平衡浓度表示平衡常数Kp=___________(用含p总的代数式表示)。
(2)研究表明,温度、压强对反应“C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g)△H”中乙苯的平衡转化率影响如下图所示:

则△H___________0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器内,充入一定量的NO和O2,800°C时发生反应2NO(g)+O2(g)![]() 2NO2(g),容器中n(NO)随时间的变化如表所示:
2NO2(g),容器中n(NO)随时间的变化如表所示:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)反应在1~2s内,O2的物质的量减少__mol。该反应在第3s___(填“达到”或“未达到”)平衡状态。
(2)如图所示,表示NO2浓度变化曲线的是___(填字母)。用O2表示0~2s内该反应的平均速率v=___mol·L-1·s-1。
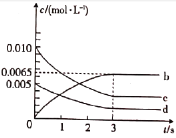
(3)能说明该反应已达到平衡状态的是___(填字母)。
a.容器内气体颜色不再变化
b.O2的物质的量保持不变
c.容器内混合气体的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 2 L的密闭容器中, 充入 1 mol N2 和 3 mol H2, 在一定的条件下反应, 2 分钟后达到平衡状态, 相同温度下, 测得平衡时混合气体的压强比反应前混合气体的压强减小了 1/10, 求:
(1) 平衡时混合气体中三种气体的物质的量比为多少______?
(2) N2 的转化率为多少 _____?
(3) 该温度下的平衡常数为多少_____ ?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年4月,中国科学院长春应用化学研究所研究员张新波课题组提出并论证了基于反应6Li+N2![]() 2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是
2Li3N,通过Li-N2可充电电池直接利用空气中的氮气实现人工固氮的可能性。电Li-N2池的结构如图所示,电解液为LiCF3SO3。下列说法正确的是

A. b极为电池的负极
B. 电池放电时Li+移向a极
C. b极的电极方程式为N2+6Li++6e- = 2Li3N
D. 金属锂在放电过程中发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A.  图中:实验现象证明氯气无漂白作用,氯水有漂白作用
图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B.  图中:收集氯气
图中:收集氯气
C. 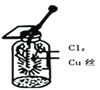 图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
图中:生成棕黄色的烟,加少量水溶解得到蓝绿色溶液
D.  图中:若气球干瘪,证明可与NaOH溶液反应
图中:若气球干瘪,证明可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com