
| A. | N2 | B. | O2 | C. | NH3 | D. | CO2 |
分析 极性分子中正负电荷的中心不重合,具有一定的极性,极性分子是由极性键构成的结构不对称的分子,以此解答该题.
解答 解:A.N2为非金属单质,只含有非极性键,为非极性分子,故A错误;
B.O2为非金属单质,只含有非极性键,为非极性分子,故B错误;
C.NH3中N原子形成3个δ键,有1个孤电子对,为sp3杂化,分子构型为三角锥形,空间结构不对称为极性分子,故C正确;
D.CO2为直线形结构,结构对称,正负电荷中心重叠为非极性分子,故D错误.
故选C.
点评 本题考查极性分子和非极性分子判断、原子杂化方式判断等知识点,侧重考查基本理论,难点是判断原子杂化方式,知道孤电子对个数的计算方法,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 都属于碱性氧化物 | B. | 溶于水后所得溶液的成分相同 | ||
| C. | 阴、阳离子个数比不同 | D. | 氧元素的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 待提纯的物质 | 除杂试剂 | 分离方法 |
| A | NH3(H2O) | 浓硫酸 | 洗气 |
| B | 乙醇(H2O) | 生石灰 | 分液 |
| C | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | 苯(苯酚) | 溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,4.48LCH3Cl中含有的原子数为NA | |
| B. | 常温常压下,14 g N2含有的核外电子数为5NA | |
| C. | 10L PH=1的硫酸中含有的氢离子数为2 NA | |
| D. | 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol C7H16中含有23 mol共价键 | |
| B. | 标准状况下1.12 L NH3中含有0.5 mol e- | |
| C. | 常温常压下0.37g 2H35Cl中含有0.2mol中子 | |
| D. | 40 g NaOH 溶于1 L水,所得溶液中c(Na+)=1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
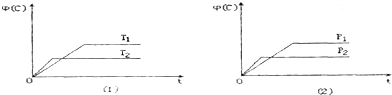
| A. | T1>T2 P1>P2 | B. | Q>0 | ||
| C. | m+n<p+q | D. | 该反应一定具有自发性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{2}$ mol | B. | 2a mol | C. | 0.1a mol | D. | (a+0.1)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
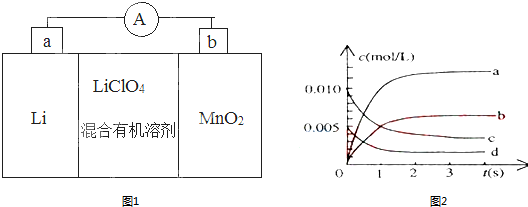
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com