
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 植物油中加入含有酚酞的NaOH溶液,微热 | 红色变浅,且不再分层 | 油脂发生了水解反应 |
| B | 柠檬醛(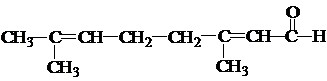 )中加入酸性高锰酸钾溶液 )中加入酸性高锰酸钾溶液 | 溶液褪色 | 柠檬醛分子中含有醛基 |
| C | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| D | 向含H2SO4的淀粉水解液中加入新制的Cu(OH)2悬浊液,煮沸 | 没有砖红色沉淀 | 淀粉未水解 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.植物油为高级脂肪酸甘油酯,能够在氢氧化钠溶液中发生水解反应;
B.该有机物分子中含有碳碳双键和醛基,碳碳双键和醛基都能够与酸性高锰酸钾溶液反应;
C.溴乙烷与NaOH溶液共热后,发生水解,检验溴离子应在酸性条件下;
D.加入氢氧化铜浊液前先用氢氧化钠中和稀硫酸.
解答 解:A.植物油是不饱和高级脂肪酸与甘油形成的酯,植物油与氢氧化钠溶液发生水解反应,导致溶液碱性变弱,溶液红色变浅,该现象能够说明油脂发生了水解反应,故A正确;
B.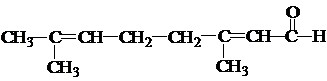
C.溴乙烷与NaOH溶液共热后发生水解,加硝酸调节至酸性条件下,再滴加AgNO3溶液,否则干扰了检验,故C错误;
D.向含H2SO4的淀粉水解液中先加入氢氧化钠溶液中和,然后加入新制的Cu(OH)2悬浊液,煮沸,否则稀硫酸与氢氧化铜反应,干扰了检验结果,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度中等,涉及油脂性质、淀粉水解、卤代烃的水解、-CHO的检验等,注重实验细节的考查,明确常见元素及其化合物性质为解答关键.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 天然植物油常温下一般呈液态,难溶于水,没有恒定的熔、沸点 | |
| B. | 棉花、蚕丝的主要成分都是纤维素 | |
| C. | 常温常压下,0.1 mol D${\;}_{2}^{18}$O中含有的中子数、质子数、电子数均为NA | |
| D. | 乙烯和苯都能使溴水中的水层褪色,褪色的原因相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| W | X | ||
| Y | Z |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 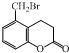 +3NaOH→ +3NaOH→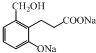 +NaBr+2H2O +NaBr+2H2O | |
| B. |  +Na2CO3→ +Na2CO3→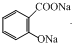 +CO2↑+H2O +CO2↑+H2O | |
| C. | n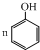 +n +n 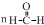 $→_{△}^{催化剂}$ $→_{△}^{催化剂}$ +(n-1)H2O +(n-1)H2O | |
| D. | C12H22O11(麦芽糖)$\stackrel{H+}{→}$C6H12O6(葡萄糖)+C6H12O6(果糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
. .
. 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com