

 ;
; ”结构的链状化合物共有7种;
”结构的链状化合物共有7种;分析 根据A→B+C(水解反应)可以判断A、B、C分别是酯、羧酸和醇,且由(2)可以确定B和C的结构分别为(CH3)2CHCOOH和(CH3)2CHCH2OH,A为(CH3)2CHCOOCH(CH3)CH2CH3;则D为 (CH3)2C=CH2,由D到E是取代反应,E为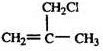 ,E发生水解得到醇F,G为醛且含有双键,可以写出其结构为CH2=C(CH3)-CHO,发生反应⑦得到羧酸H为CH2=C(CH3)COOH,H与CH3OH得到酯I为CH2=C(CH3)-COOCH3,则J为加聚反应的产物,为
,E发生水解得到醇F,G为醛且含有双键,可以写出其结构为CH2=C(CH3)-CHO,发生反应⑦得到羧酸H为CH2=C(CH3)COOH,H与CH3OH得到酯I为CH2=C(CH3)-COOCH3,则J为加聚反应的产物,为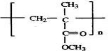 ,据此分析解答.
,据此分析解答.
解答 解:根据A→B+C(水解反应)可以判断A、B、C分别是酯、羧酸和醇,且由(2)可以确定B和C的结构分别为(CH3)2CHCOOH和(CH3)2CHCH2OH,则D为 (CH3)2C=CH2,由D到E是取代反应,E为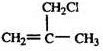 ,E发生水解得到醇F,G为醛且含有双键,可以写出其结构为CH2=C(CH3)-CHO,发生反应⑦得到羧酸H为CH2=C(CH3)COOH,H与CH3OH得到酯I为CH2=C(CH3)-COOCH3,则J为加聚反应的产物,为
,E发生水解得到醇F,G为醛且含有双键,可以写出其结构为CH2=C(CH3)-CHO,发生反应⑦得到羧酸H为CH2=C(CH3)COOH,H与CH3OH得到酯I为CH2=C(CH3)-COOCH3,则J为加聚反应的产物,为 ,
,
(1)通过以上分析知,①是水解反应或取代反应,③是消去反应,
故答案为:水解反应或取代反应;消去反应;
(2)通过以上分析知,C为(CH3)2CHCH2OH,其名称是2-甲基-1-丙醇,A为(CH3)2CHCOOCH(CH3)CH2CH3,故答案为:2-甲基-1-丙醇;(CH3)2CHCOOCH(CH3)CH2CH3;
(3)由以上分析可知G为CH2=C(CH3)-CHO,⑨的化学方程式为 ,
,
故答案为: ;
;
(4)H为CH2=C(CH3)COOH,H同分异构体中含有“ ”结构的链状化合物,可能是CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、CH3COOCH=CH2、HCOOCH=CHCH3、HCOOCH2CH=CH2、
”结构的链状化合物,可能是CH2=CHCH2COOH、CH3CH=CHCOOH、CH2=CHCOOCH3、CH3COOCH=CH2、HCOOCH=CHCH3、HCOOCH2CH=CH2、
HCOOC(CH3)=CH2,所以有7种;
其中同分异构体符合下列条件:
(Ⅰ)能发生水解反应说明含有酯基;
(Ⅱ)能使溴的四氯化碳溶液褪色说明含有碳碳双键;
(Ⅲ)能发生银镜反应,说明含有醛基,为甲酸酯;
(Ⅳ)核磁共振氢谱峰面积之比为3:2:1,说明有3种氢原子,且氢原子个数之比为3:2:1,符合条件的同分异构体结构简式为HCOOC(CH3)=CH2,
故答案为:7;HCOOC(CH3)=CH2.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,根据图中反应条件结合分子式进行推断,正确推断各物质结构简式是解本题关键,难点是(4)题同分异构体种类判断,注意:甲酸酯能发生银镜反应,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.| 时间/min 浓度/mol/L | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(CO)/mol | H2O/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,到达平衡时n(CO2)=0.30mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是最简单的烃,其含碳量最高 | |
| B. | 烷烃完全燃烧时,生成CO2和H2O的物质的量相等 | |
| C. | 苯不能与氢气加成,说明苯不具备单双建交替结构 | |
| D. | 任何烯烃完全燃烧时,生成CO2和H2O的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| B. | 图①表示25℃时,用0.1mol•L-1盐酸滴定20mL 0.1mol•L-1NaOH溶液,溶液的pH随加入酸体积的变化 | |
| C. | 图③表示10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com