
【题目】有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
FeO(s) + CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。
(1)能判断该反应达到平衡状态的依据是 (双选,填序号)。
A.容器内压强不变了
B.C(CO)不变了
C.v正(CO2)=v逆(CO)
D.C(CO2):c(CO)=1:1
(2)该反应的逆反应是_________(选填“吸热”、“放热”)反应。
(3)写出该反应的平衡常数表达式__________。若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=__________(保留二位有效数字)。
(4)若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。①升高温度__________;②再通入CO___________。
【答案】(1)B、C (2)放热 (3)k=c(CO)/c(CO2)), 1.0 (4)减小 不变
【解析】
试题分析:(1)A、该反应为反应前后气体物质的量不变的反应,容器内的压强不随时间的变化而变化,容器内压强不能作为达到平衡的标志,错误;B、c(CO)不变,说明达到了平衡状态,正确;C、v正(CO2)=v逆(CO) ,正逆反应速率相等,达到了平衡状态,正确;D、c(CO2)=c(CO),无法判断是否达到平衡状态,错误,选BC。
(2)在温度938K时,平衡常数K=1.5,在1173K时,K=2.2,温度升高,化学平衡常数增大,说明该反应为吸热反应,逆反应为放热反应。
(3)由可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),该反应的平衡常数表达式为:K=c(CO)/c(CO2);CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则反应消耗的二氧化碳的浓度为:1.0mol/L,达到平衡时二氧化碳浓度为1.0mol/L,则该温度下的平衡常数为K=c(CO)/c(CO2)=1。
FeO(s)+CO(g),该反应的平衡常数表达式为:K=c(CO)/c(CO2);CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0mol/L,则反应消耗的二氧化碳的浓度为:1.0mol/L,达到平衡时二氧化碳浓度为1.0mol/L,则该温度下的平衡常数为K=c(CO)/c(CO2)=1。
(4)①该反应为吸热反应,升高温度,平衡向着正向移动,二氧化碳的体积分数减小;②再通入CO,相当于增大压强,平衡不移动,达到平衡时各组分的含量不变。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】某实验小组用下图装置制备家用消毒液,并探究其性质。
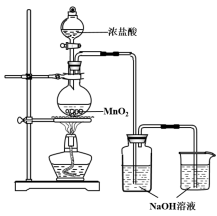
反应停止后,取洗气瓶中无色溶液5mL分别进行了如下实验:
操作 | 现象 |
a. 测溶液pH, 并向其中滴加2滴酚酞 | pH = 13, 溶液变红,5min后褪色 |
b. 向其中逐滴加入盐酸 | 溶液逐渐变成黄绿色 |
(1)写出利用上述装置制备消毒液涉及反应的化学方程式 、 。
(2)查阅资料:酚酞的变色范围为8.2~10,且酚酞在强碱性溶液中红色会褪去
为探究操作a中溶液褪色的原因,又补充了如下实验:
操作 | 现象 |
取 NaOH溶液,向其中滴加2滴酚酞 | 溶液变红,30min后褪色 |
获得结论:此实验小组制备的消毒液具有 性。
(3) 该小组由操作b获得结论:随着溶液酸性的增强,此消毒液的稳定性下降。
① 操作b中溶液变成黄绿色的原因: (用离子方程式表示)。
② 有同学认为由操作b获得上述结论并不严谨,需要进一步确认此结论的实验方案是 。
(4) 有效氯的含量是检测含氯消毒剂消毒效果的重要指标。具体用“单位质量的含氯消毒液在酸性条件下所能释放出氯气的质量”进行表征,一般家用消毒液有效氯含量在5%以上。小组同学进行如下实验测定有效氯:取此消毒液5 g,加入20 mL 0.5 mol·L-1 KI溶液,10 mL 2 mol·L-1的硫酸溶液;加几滴淀粉溶液后,用0.1 mol·L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3 20 mL。(已知:2S2O32- + I2 === S4O62- + 2I-) 。注:相对原子质量Cl35.5,Na23,S32,O 16 ,I 127, K39
①达到滴定终点时的实验现象是 。
②此消毒液有效氯含量为 %(保留一位有效数字)。获得结论:此实验制得的消毒液 (填“符合”或“不符合”)家用要求。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.乙烯是石油裂解气的主要成分,下图是石蜡油在炽热碎瓷片的作用下裂解,下列装置检验其性质,完成下列问题。

(1)A中碎瓷片的作用是_____________。
(2)B中反应类型是_____________,C中实验现象是__________________。
II.用如图所示的装置进行实验,回答下列问题:
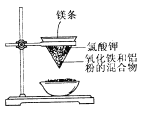
(1)写出该反应的化学方程式:_____________________。
(2)选出该实验的实验现象(把序号填写在横线上):________________。
①镁条剧烈燃烧;②放出大量的热,并发出耀眼的光芒;③纸漏斗的下部被烧穿;④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体。
(3)写出下列操作或物质的作用:镁条________;氯酸钾_________;蒸发皿盛沙____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲酸钾是一种白色晶体,商品名为弗米(Formil),是一种能替代抗生素的促生长剂,化学式为KH(HCOO)2,具有吸湿性,易溶于水。
二甲酸钾的生产工艺流程如下:
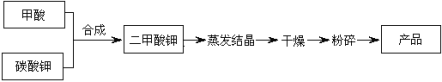
(1)写出甲酸和碳酸钾生产二甲酸钾的化学方程式: 。
(2)测定某弗米产品纯度的实验方法如下:
称取该弗米产品2.5g,将其全部溶解在水中,配制成250mL未知浓度的溶液,取出25.00mL于锥形瓶中,再滴加2~3滴指示剂,用0.10mol·L-1的NaOH溶液滴定至终点,消耗NaOH溶液的体积为18.50mL。
①加入的指示剂是 (选填“甲基橙”、“石蕊”或“酚酞”),用NaOH溶液滴定至终点的现象是 。
②上述弗米产品中二甲酸钾的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为相互串联的甲、乙两电解池,试回答:

(1)甲池若为用电解原理精炼铜的装置,则:A是________极,材料是________,电极反应为 ,电解质溶液为________。当一极有1mol纯铜析出时,另一极溶解的铜 1mol(填“大于”、“小于”、“等于”)。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe电极附近呈________色,电极反应式为 。
(3)若甲池中阴极增重12.8g,则乙池中阳极放出的气体在标准状况下的体积为______L,若此时乙池剩余液体为400 mL,则电解后溶液的pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【物质结构】硼是一种重要的非金属元素,在化学中有很重要的地位。
(1)基态硼原子电子排布图为 ,核外有 种运动状态不同的电子。
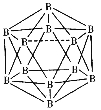
(2)晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),若其中有两个原子为10B,其余为11B,则该结构单元有 种不同的结构类型。
(3)无定形硼与Cl2反应得到BCl3,BCl3的空间构型为 。
(4)氨硼烷是一种有效、安全的固体储氢材料。氨硼烷的结构和乙烷相似(如图),B、N原子的杂化轨道类型分别为 和 ,氨硼烷 (填“能”或“不能”)溶于水。
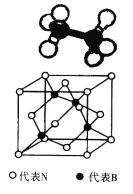
(5)立方氮化硼的结构与金刚石相似,其晶胞如图所示,则晶胞顶点上的原子的配位数为 。若晶胞的边长为a nm,则立方氮化硼的密度表达式为 g/cm3(设NA为阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“C化学”是指以碳单质或分子中含1个碳原子的物质(如CO、CO2、CH4、CH3OH等)为原料合成工业产品的化学工艺,对开发新能源和控制环境污染有重要意义。
(1)一定温度下,在两个容积均为2 L的密闭容器中,分别发生反应:CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
CH3OH(g) + H2O(g) ΔH=-49.0 kJ/mol。相关数据如下:
容器 | 甲 | 乙 |
反应物投入量 | 1 mol CO2(g)和3 mol H2(g) | 1 mol CH3OH(g)和1 mol H2O(g) |
平衡时c(CH3OH) | c1 | c2 |
平衡时能量变化 | 放出29.4 kJ | 吸收a kJ |
请回答:①c1 c2(填“>”、“<”或“=”);a= 。
②若甲中反应达到平衡耗时10 s,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(2)向体积为1 L的密闭容器中充入b mol CO和2b mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:
CH3OH(g)。平衡时CO的转化率与温度的关系如图所示。请回答下列问题:

①正反应属于 (填“吸”或“放”)热反应。
②100℃时,该反应的平衡常数K= (用含b的代数式表示)。
(3)治理汽车尾气的反应是2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
2CO2(g)+N2(g) ΔH<0。在恒温恒容的密闭容器中通入n(NO):n(CO)=1:2的混合气体,发生上述反应。下列图像正确且能说明反应在进行到t1时刻一定达到平衡状态的是 (选填字母)
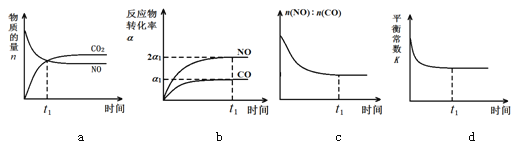
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°。由此可见,BeCl2属于
A. 由极性键构成的极性分子
B. 由极性键构成的非极性分子
C. 由非极性键构成的极性分子
D. 由非极性键构成的非极性分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com