
【题目】可逆反应:2NO2(g)![]() 2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
2NO(g)+ O2(g) 在体积不变的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
A. ①④ B. ②③⑤ C. ①③④ D. ①②③④⑤
【答案】D
【解析】
试题此题列出了判断可逆反应是否达到平衡状态的各种可能情况,应从平衡状态的两个重要特征上判断(1)v(正)=v(逆),(2)混合物中各组成成分的百分含量不变。①单位时间内生成n mol O2等效于单位时间内消耗2n mol NO2的同时生成2n mol NO2,符合特征(1);②单位时间内生成n mol O2的同时生成2n mol NO,都体现的正向,不符合特征(1);③说明了反应中各物质的转化量的关系;④NO2是红棕色气体,颜色不变时说明NO2的浓度保持不变,符合特征(2);⑤中是恒容条件,则ρ始终不变,不能说明平衡状态;故①④能说明是否达到平衡状态,故选A。


科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。

(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:

①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。

①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用硫酸渣(主要成分为Fe2O3和少量的SiO2、FeO)可以制备高纯度的氧化铁,制备流程如图:
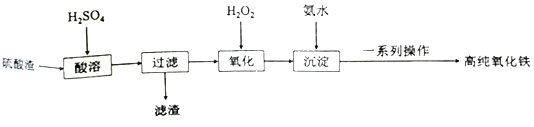
(1)滤渣的主要成分是___。
(2)“氧化”时发生反应的离子方程式为___。
(3)检验沉淀是否完全的方法为___。
(4)一系列操作包括:过滤、沉涤、干燥、___。
(5)用高温分解FeSO4也可以制备较纯的Fe2O3,写出反应的化学方程式___。
(6)上述硫酸渣含铁28%,现需高纯氧化铁64吨,理论上需用硫酸渣多少吨?___(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能充分说明可逆反应N2(g)+O2(g)![]() 2NO(g)已达到平衡状态的是( )
2NO(g)已达到平衡状态的是( )
A. 容器内压强不随时间改变
B. 容器内反应物总物质的量不随时间改变
C. 容器内气体N2、O2、NO的分子数之比为1:1:2
D. 单位时间内每消耗n mo1N2,同时生成2n mo1NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成NH3所需的H2可由煤与H2O反应制得,其中有一步反应为:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
CO2(g)+H2(g) △H>O,欲提高CO转化率可采用的方法可能有①降低温度②增大压强③使用催化剂④增大CO的浓度⑤增大水蒸气的浓度,其中正确的组合是( )
A. ①②③B. ④⑤C. ①⑤D. ⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以熔融的碳酸盐(K2CO3)为电解液,泡沫镍为电极,氧化纤维布为隔膜(仅允许阴离子通过)可构成直接碳燃料电池,其结构如图所示,下列说法正确的是

A.该电池工作时,CO32-通过隔膜移动到b极
B.若a极消耗1mol碳粉,转移电子数为4NA
C.b极的电极反应式为2CO2+O2-4e-=2CO32-
D.为使电池持续工作,理论上需要补充K2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为探究SO2、Cl2的性质,并比较SO2和氯水的漂白性,设计了如下的实验。

(1)图中盛放浓盐酸仪器的名称为___,装置A中发生反应的化学方程式___。
(2)反应一段时间后,B、D中品红褪色。反应结束后,分别加热B、D中的试管,可观察到的现象为:B___、D___。
(3)C装置的作用是吸收尾气,写出SO2与足量NaOH溶液反应的离子方程式:___。
(4)有同学将SO2和Cl2按1:1同时通入到品红溶液中,发现褪色效果并不明显。可能的原因是___(用化学方程式表示),设计实验证明上述原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物 H(结构简式为  )是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物 M 的单体,H可以通过有机物A(分子式为 C7H8O)和丙酮为原料来进行合成,其合成路线如下:

已知:① ![]()
②
请回答下列问题:
(1)A结构简式为_____,C 中所含官能团的名称是_____;①和③的反应类型分别是_____。
(2)简述溴乙烷中溴原子检验方法_____。
(3)高分子化合物M 的结构简式为_____。
(4)反应③的化学反应方程式为_____。
(5)有机物 C 有多种同分异构体,其中苯环上只有两个侧链的芳香酯的同分异构体有_____种。
(6)设计由苯甲醛和 2-丙醇制备![]() 的合成路线_____(无机试剂任选)。
的合成路线_____(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是
A.溴乙烷发生消去反应:![]()
B.向![]() 溶液中加入过量氨水:
溶液中加入过量氨水:![]()
C.向![]() 溶液中加入过量
溶液中加入过量![]() 溶液:
溶液:![]()
D.向含![]() 和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L
和KOH均为0.1 mol的混合溶液中通人标准状况下4.48 L![]() 气体:
气体:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com