
����Ŀ����֪�������ữ�IJ��ᣨH2C2O4����Һ����KMnO4��Һ��Ӧ��ij��ѧС���о����֣�����MnSO4�ɶԸ÷�Ӧ������ã�Ϊ��һ���о��й����ضԸ÷�Ӧ���ʵ�Ӱ�죬̽�����£�
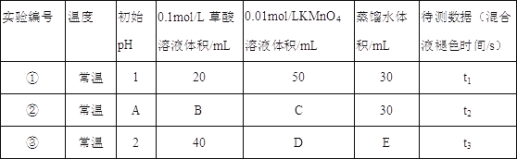
��1�������£�̽����ͬ�ij�ʼpH�Ͳ�����ҺŨ�ȶԷ�Ӧ���ʵ�Ӱ�죬�������ʵ�飬��A=____��C=____��E=_____��
��2���÷�Ӧ�����ӷ���ʽ______________________________________��
��3����t1��t2�������ʵ��ٺ͢ڵõ��Ľ�����_____________________________��
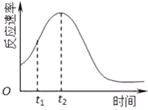
��4��С��ͬѧ����ÿ��ʵ�鷴Ӧ������ʱ��ı仯������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ���__________________����__________________________��
��5����ѧС���õζ����ⶨKMnO4��Һ���ʵ���Ũ�ȣ�ȡag���ᾧ�壨H2C2O42H2O��Ħ������126g/mol������ˮ���250mL��Һ��ȡ25.00mL��Һ������ƿ�У���������ϡH2SO4�ữ������KMnO4��Һ�ζ����յ㣬�ظ��ζ����Σ�ƽ������KMnO4��ҺVmL���ζ������յ�������ǣ�______________________________��ʵ��������Ķ���������__________________�����������ƣ�����KMnO4��Һ�����ʵ���Ũ��Ϊ____mol/L��
���𰸡�2 50 10 5H2C2O4+2MnO4��+6H+=10CO2��+2Mn2++8H2O ����������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�� �÷�Ӧ���� ����Mn2+�Ƿ�Ӧ�Ĵ��� �������һ��KMnO4��Һ����Һ��Ϊ��ɫ����30s�ں�ɫ����ȥ ������ƽ��250mL����ƿ������ʽ���ζ��� ![]()
��������
��1�����ݱȽ���������Է�Ӧ���ʵ�Ӱ�죬ֻ������һ��������ͬ����������������ͬȷ����
��2�������������ط�Ӧ���������ӺͶ�����̼��ˮ��
��3������pH��ͬ���Է�Ӧ���ʵ�Ӱ��ȷ����
��4�������¶Ⱥʹ����Է�Ӧ���ʵ�Ӱ�������
��5��������ر�������ɫ���ʲ���Ҫ����ָʾ��������������������ƽ������250mL��Һ��250mL����ƿ����ȡKMnO4��Һ�Ͳ�����Һ�õ���ʽ�ζ��ܣ����ù�ϵʽ�����м��㣻
��1�����ݸ�ʵ��̽����ͬ�ij�ʼpH�Ͳ�����ҺŨ�ȶԷ�Ӧ���ʵ�Ӱ�죬ʵ��Ҫ�����KMnO4��Һ��ʼŨ����ͬ����KMnO4��Һ�����Ϊ50mL�������Ϊ100mL����C=50��D=50��B=20��E=10��̽����������Է�Ӧ���ʵ�Ӱ�죬�豣֤����������ͬ��ͨ�����������֪����ڵ�pH��ͬ������۵IJ���Ũ�Ȳ�ͬ����A=2��
�𰸣�2��50��10��
��2�������������ط�Ӧ�������ӺͶ�����̼��ˮ���䷴Ӧ�����ӷ���ʽΪ��5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��
�𰸣�5H2C2O4+2MnO4-+6H+=10CO2��+2Mn2++8H2O��
��3��ʵ��ٺ͢�ֻ��pH��ͬ��������������ͬ������t1<t2��˵������������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�죻
�𰸣�����������ͬʱ����Һ�ij�ʼpHԽС���÷�Ӧ�ķ�Ӧ����Խ�죻
��4�����ڸ÷�Ӧ��Ӱ�컯ѧ��Ӧ������ֻ���¶Ⱥʹ��������Է�Ӧ������ʱ��ı仯������ͼ������t1��t2ʱ�������ʱ�����Ҫԭ������ǣ���Ӧ���ȵ����¶��������Mn2+�Ƿ�Ӧ�Ĵ�����
�𰸣��÷�Ӧ���ȣ�����Mn2+�Ƿ�Ӧ�Ĵ�����
��5��������ر�������ɫ���ʲ���Ҫ����ָʾ�������ᷴӦ��ϣ��������һ��KMnO4��Һ����Һ��Ϊ��ɫ����ɫ30s�ڲ���ȥ��˵���ζ����յ㣻����������������ƽ������250ml��Һ��250mL����ƿ����ȡKMnO4��Һ�Ͳ�����Һ�õ���ʽ�ζ��ܣ�
c�����ᣩ=![]() =
=![]() mol/L
mol/L
�ɹ�ϵʽ 2KMnO4 �� 5H2C2O4
2 5
cmolL-1��V��10-3L ![]() mol/L��25��10-3mol
mol/L��25��10-3mol
c=![]() mol/L
mol/L
�𰸣��������һ��KMnO4��Һ����Һ��Ϊ��ɫ����30s�ں�ɫ����ȥ��������ƽ��250mL����ƿ������ʽ���ζ��ܣ�![]()


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Cu-Znԭ���װ�ã�����ͼ��ʾ���������У�����ȷ���ǣ� ��

A.ͭƬ������ɫ��������
B.пƬ���������缫��Ӧʽ��Zn-2e-=Zn2+
C.����һ��ʱ�����Һ��c(H+)��С
D.���Ӵ�ͭƬ����������пƬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֦������������о�����ṹ��ʽΪ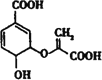 �����й��ڷ�֦���˵������ȷ����
�����й��ڷ�֦���˵������ȷ����
A.�����к���3�ֺ���������
B.1mol��֦��������2molNaOH�����кͷ�Ӧ
C.��һ�������¿����Ҵ������ᷴӦ������Ӧ���Ͳ���ͬ
D.��ʹ������Ȼ�̼��Һ�����Ը��������Һ��ɫ������ɫԭ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѹǿ�仯����ʹ���л�ѧ��Ӧ��ƽ�ⷢ���ƶ����� ( ��
A. H2(��)��I2(��) ![]() 2HI(��)
2HI(��)
B. 3H2(��)��N2(��) ![]() 2NH3(��)
2NH3(��)
C. 2SO2(��)��O2(��) ![]() 2SO3(��)
2SO3(��)
D. C(��)��CO2(��) ![]() 2CO(��)
2CO(��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����°��Ƽ��������Ϊ��
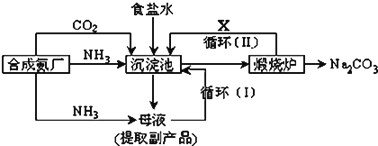
![]() �������з�Ӧ�Ļ�ѧ����ʽ��________________________________��
�������з�Ӧ�Ļ�ѧ����ʽ��________________________________��
![]() �����Ʒ̼�������Ƿ����Ȼ��ƵIJ�������Ϊ��___________________________
�����Ʒ̼�������Ƿ����Ȼ��ƵIJ�������Ϊ��___________________________
![]() ��������������X�ķ���ʽΪ ______
��������������X�ķ���ʽΪ ______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ���������Ϊ��ѧ��ѧ�������ʣ�һ������������������ת����ϵ![]() ������������ȥ
������������ȥ![]() ��
��
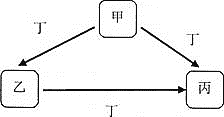
![]() ����ΪKOH��Һ��д���ҵ�һ����;________����
����ΪKOH��Һ��д���ҵ�һ����;________����![]() �������ӷ���ʽΪ________��
�������ӷ���ʽΪ________��
![]() ����ΪFe��д�������Һ�м���NaOH��Һ�Ļ�ѧ����ʽ��________����ʵ������Ϊ________��
����ΪFe��д�������Һ�м���NaOH��Һ�Ļ�ѧ����ʽ��________����ʵ������Ϊ________��
![]() ���ס��ҡ�����Ϊ��ɫ��Ӧ�ʻ�ɫ�Ļ��������Ϊ________��
���ס��ҡ�����Ϊ��ɫ��Ӧ�ʻ�ɫ�Ļ��������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵������ȷ����
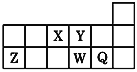
A.W��Y��Ӧ�ļ��⻯��ķе�ǰ�߸�
B.�����ӵĻ�ԭ�ԣ�W2->Q-
C.���Ӱ뾶��Y2��>Z3��
D.Ԫ�صķǽ����ԣ�Y>W
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����
A.��KI��Һ��ͨ������������Cl2��2I����2Cl����I2
B.��Na2SiO3��Һ�еμ����Na2SiO3��2H����H2SiO3����H2O
C.����ˮ��ͨ��������������Cl2��H2O��SO2��2H����2Cl����SO![]()
D.��ϡHNO3��Һ�м�������ͭ�ۣ�Cu��4H����2NO![]() ��Cu2����2NO2����2H2O
��Cu2����2NO2����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ݷ��������������ſ�Ԥ���л�����������ʡ�
�����л������У�����H2�����ӳɷ�Ӧ����______(����ĸ)��
a��CH3Cl b��CH��CH c��CH3CH2OH
�����л������У�����NaHCO3������Ӧ����______(����ĸ)��
a��CH3CH2OH b��CH3CHO c��CH3COOH
�����л������У�����FeCl3��Һ����ɫ����______(����ĸ)��
a��![]() b��
b��![]() c��
c��![]()
��2������ϩ�����(![]() )�Ǻϳ��л������ĵ��塣
)�Ǻϳ��л������ĵ��塣
��1 mol����ϩ����������______ mol H2������Ӧ��
��д������ϩ�����������������ˮ��Ļ�ѧ����ʽ��______��
���л��������ɼ���ϩ�����ͨ���Ӿ۷�Ӧ�õ����л������Ľṹ��ʽΪ______��
��3��ˮ��ȩ��һ����Ȼ���ϵ��м��壬��ͨ�����з����ϳɣ�

��B�й����ŵ�����Ϊ______��______��
��A��B�ķ�Ӧ����Ϊ______��
��ˮ��ȩ�Ľṹ��ʽΪ______��
��ˮ��ȩ��ͬ���칹��X�ܷ���ˮ�ⷴӦ����1 mol X�������2 mol NaOH��Ӧ��д��������������X�Ľṹ��ʽ��______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com