
【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33 ℃,沸点:73 ℃。实验室可用如图装置制取 ICl3。
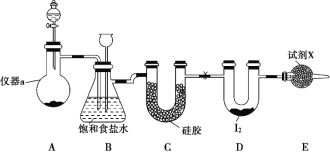
(1)仪器 a 的名称是_____。
(2)制备氯气选用的药品为漂白精固体[ 主要成分为 Ca(ClO)2] 和浓盐酸, 相关反应的化学方程式为______。
(3)装置 B 可用于除杂,也是安全瓶,能监测实验进行时装置 C 中是否发生堵塞,请写出发生堵塞时 B 中的现象是 ____。
(4)试剂 X 为_____。
(5)氯气与单质碘反应温度稍低于 70 ℃,则装置 D 适宜的加热方式为__。
【答案】(1)蒸馏烧瓶(2分);(2)Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O(3分);
(3)吸滤瓶中液面下降,长颈漏斗中液面上升(2分);(4)碱石灰(2分);(5)水浴加热(2分)。
【解析】
试题(1)根据图示可知仪器a 的名称是蒸馏烧瓶;(2)漂白精固体[主要成分为Ca(ClO)2]和浓盐酸混合发生反应制备氯气,反应的化学方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;(3)装置B可用于除杂,也是安全瓶,能监侧实验进行时装置C中是否发生堵塞,若装置C发生堵塞,则在装置B中气体压强增大,会把吸滤瓶中的液体压入长颈漏斗中,使吸滤瓶中液面下降,长颈漏斗中液面上升;(4)在装置D中Cl2与I2发生反应产生ICl3,Cl2是有毒气体会造成大气污染,图示空气中的水蒸气进入装置D也会影响ICl3的制备,所以试剂X可用于吸收氯气和水蒸气,该试剂为碱石灰;(5)氯气与单质碘需在温度稍低于70℃下反应。为便于控制反应温度,则装置D适宜的加热方式为水浴加热。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差l;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
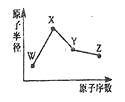
A. 对应简单离子半径:W>X
B. 对应气态氢化物的稳定性:Y<Z
C. 化合物XZW既含离子键,又含极性共价键
D. Z的氢化物和X的最高价氧化物对应水化物的溶液均能与Y的氧化物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯是重要的有机化工原料,主要用于生产聚丙烯、丙烯腈、环氧丙烷等.
Ⅰ.(1)以丁烯和乙烯为原料反应生成丙烯的方法被称为“烯烃歧化法”,反应为:C4H8(g)+C2H4(g)![]() 2C3H6(g)。已知:
2C3H6(g)。已知:
①C2H4(g)+3O2(g)═2CO2(g)+2H2O(l)△H 1=-1411KJmol-1
②C3H6(g)+![]() O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
O2(g)═3CO2(g)+3H2O(l)△H 2=-2049KJmol-1
③C4H8(g)+6O2(g)═4CO2(g)+4H2O(l)△H 3=-2539KJmol-1
“烯烃歧化法”的反应的热化学方程式为_____________________。
(2)一定温度下,在一体积恒为 V 升的密闭容器中充入一定量的 C4H8 和 C2H4,发生烯烃歧化法的 主要反应。 t1 时刻达到平衡状态,此时容器中 n(C4H8)=amol,n(C2H4)=2amol,n(C3H6)=b mol, 且 C3H6 占平衡总体积的 1/4。
①求该时间段内的反应速率 v(C4H8)=_____________。 (用只含 a、V、t1 的式子表示)
②判断该反应达到平衡的标志是______________
A.2v (C4H8) 生成=v (C3H6) 消耗
B.C4H8、C2H4、C3H6 的物质的量之比为 1:1:2
C.混合气体的平均相对分子质量不再改变
D.C4H8、C2H4、C3H6 的浓度均不再变化
(3)Kp 是用反应体系中气体物质的分压来表示的平衡常数,即将 K 表达式中平衡浓度用平衡分压代替。已知反应﹕C4H8(g)+C2H4(g)![]() 2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
2C3H6(g),该反应中正反应速率v 正=k 正·p(C4H8)·p(C2H4),逆反应速率 v 逆=k 逆·p2(C3H6),其中 k 正、k 逆 为速率常数,则 Kp 为_________(用 k 正、k 逆表示)。
Ⅱ.“丁烯裂解法”是另一种重要的丙烯生产法,但生产过程中会有生成乙烯的副反应发生.反应如下主反应:3C4H8![]() 4C3H6;副反应:C4H8
4C3H6;副反应:C4H8![]() 2C2H4
2C2H4
测得上述两反应的平衡体系中,各组分的质量分数(w%)随温度(T)和压强(P)变化的趋 势分别如图 1 和图 2 所示:
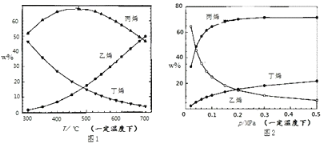
(1)平衡体系中的丙烯和乙烯的质量比是工业生产丙烯时选择反应条件的重要指标之一,从产物的纯度考虑,该数值越高越好,从图 1 和图 2 中表现的趋势来看,下列反应条件最适宜的是_____(填字母序号).
A.300oC 0.1MPa B.700oC 0.1MPa C.300oC 0.5MPa D.700oC 0.5MPa
(2)有研究者结合图 1 数据并综合考虑各种因素,认为 450℃的反应温度比 300℃或 700℃更合适, 从反应原理角度分析其理由可能是________________.
(3)图2中,随压强增大平衡体系中丙烯的百分含量呈上升趋势,从平衡角度解释其原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的 L 层电子数为 ___________;
(2)肼(N2H4)又称联氨。无色油状液体。有类似于氨的刺鼻气味。可作为火箭发动机的燃料。
①)肼中氮元素的化合价为 ____。
②NH3 与 NaClO 反应可得到肼,该反应的化学方程式为_____。
③16g 液态肼在空气中燃烧,生成氮气和水蒸气时放出的热量为 267.1kJ,写出该反应的热化学方程式: ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种以肼(N2H4)为燃料的新型环保电池的工作原理如图所示。下列说法正确的是
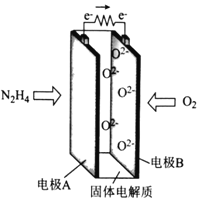
A. 电极A的电势比电极B的低
B. 电极A的电极反应式为N2H4-4e-+4OH-===N2+4H2O
C. 电极B发生氧化反应
D. 每消耗11.2L的O2,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅(Si3N4)肼(N2H4)、氢氰酸(HCN)。
(1)已知:Si(s)+2Cl2(g)====SiCl4(g) △H1=akJ·mol-1
N2(g)+3H2(g) ![]() 2NH3(g) △H2=bkJ·mol-1
2NH3(g) △H2=bkJ·mol-1
3Si(s)+2N2(g)====Si3N4(s) △H3=ckJ·mol-1
H2(g)+Cl2(g)====2HCl(g) △H4=dkJ·mol-1
则反应3SiCl4(g)+4NH3(g)====Si3N4(s)+12HCl(g)的△H=________________kJ·mol-1(用a、b、c、d表示)。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知ClO-水解的方程式为:ClO-+H2 O=HClO+OH-。常温下,该水解反应的平衡常数为K=1.0×10-6mol·L-1,则1.0mol· L -1NaCIO溶液的pH=________。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为:CH4(g)+NH3(g) ![]() HCN(g)+3H2 (g) △H>O
HCN(g)+3H2 (g) △H>O
①其他条件一定,达到平衡时NH3转化率随外界条件X变化的关系如图所示。X代表的是________(填“温度”或“压强”)。
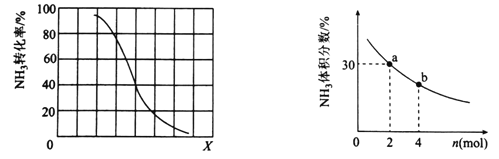
②其他条件一定,向2L密闭容器中加人 n mol CH4和2 mol NH3,平衡时NH3体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为10min,该时间段内用CH4的浓度变化表示的反应速率为________mol·L-1·min-1;平衡常数:K(a) ________K(b)(填“>”“=”或“<”)
③工业上用电解法处理含氰电镀废水(pH=10)的装置如图所示。
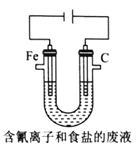
阳极产生的氯气与碱性溶液反应生成ClO-,ClO-将CN-氧化的离子方程式为:_____CN-+ _____ClO-+ ________====_____CO32-+_____N2↑+________+________若电解处理2 mol CN-,则阴极产生气体的体积(标准状况下)为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图甲和乙是双液原电池装置。由图可判断下列说法错误的是( )

A. 乙图电池反应的离子方程式为:Co(s)+2Ag+(aq)=2Ag(s)+Co2+(aq)
B. 反应2Ag(s)+Cd2+(aq)=Cd(s)+2Ag+(aq) 不能发生
C. 盐桥的作用是形成闭合回路,并使两边溶液保持电中性
D. 甲图当有1mol电子通过外电路时,正极有59g Co析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某一可逆反应来说,使用催化剂的作用是( )
A.提高反应物的平衡转化率B.以同样程度改变正、逆反应速率
C.增大反应的活化能D.改变平衡混合物的组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com