
硅单质及其化合物应用很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下 :




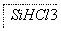



①写出由纯SiHCl3制备高纯硅的化学反应方程式____________________。
②整个制备过程必须严格控制无水、无氧。SiHCl3遇水剧烈反应生成H2SiO3、
HCl和另一种物质,写出配平的化学反应方程式____________________;H2
还原SiHCl3过程中若混有O2,可能引起的后果是____________________。
(2)下列有关硅材料的说法正确的是 ( )。
A.单质硅化学性质稳定,但可以被强碱溶液腐蚀
B.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
C.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
D.光导纤维的主要成分是SiO2
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入盐酸,
振荡。写出实验现象并给予解释(用化学方程式说
明)____________________________________________________________。
(4)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,
这种材料是________(填字母)。
A.高温结构陶瓷 B.生物陶瓷 C.导电陶瓷
解析 ①SiHCl3和H2在高温下反应得到高纯硅的同时,可得到HCl,因此化
学方程式为SiHCl3+H2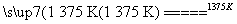 Si+3HCl,②SiHCl3遇水剧烈反应生成
Si+3HCl,②SiHCl3遇水剧烈反应生成
H2SiO3、HCl和另一种物质,不难得出另一种物质为氢气,从而写出反应化学方程式,当混有氧气时,氢气和氧气会发生反应,可能会引起爆炸,另外,氧气也可能会氧化SiHCl3;(2)A、D比较简单,属于正确的说法,B中,单晶
硅性质稳定,能与氢氟酸反应,而不能与盐酸反应,所以这一说法是错误的;C中要注意玻璃是混合物,不具备固定的熔沸点,所以C错误;(3)用盐酸制取硅酸,由于硅酸不溶于水,所以可以看到有白色絮状沉淀产生,反应化学方程式为Na2SiO3+2HCl===2NaCl+H2SiO3↓;(4)因是植入人体内,因此选用生物陶瓷,故选择B。
答案 (1)①SiHCl3+H2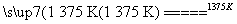 Si+3HCl
Si+3HCl
②SiHCl3+3H2O===H2SiO3+H2↑+3HCl↑
高温下,H2遇O2可能会引起爆炸;O2可能会氧化SiHCl3
(2)AD
(3)生成白色絮状沉淀,Na2SiO3+2HCl===2NaCl+H2SiO3↓
(4)B


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
某市拟投资建设一个工业酒精厂,目的是用工业酒精与汽油混合制成“乙醇汽油”,以节省石油资源。已知制酒精的方法有三种:
①在催化剂作用下乙烯与水反应;
②CH3CH2Br+H2O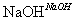 CH3CH2OH+HBr;
CH3CH2OH+HBr;
③(C6H10O5)n(淀粉)+nH2O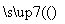 nC6H12O6(葡萄糖)
nC6H12O6(葡萄糖)
C6H12O6(葡萄糖)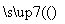 2C2H5OH+2CO2↑。
2C2H5OH+2CO2↑。
(1)方法①的化学反应方程式是_________________________________________。
(2)方法②的化学反应类型是____________。
(3)为缓解石油短缺带来的能源危机,你认为该市应选用哪一种方法生产工业酒精?__________,请简述理由: _______________________________________________________
________________________________________________________________________________________________________________________________________________。
(4)如果从绿色化学(“原子利用率”最大化)的角度看,制酒精最好的一组方法是( )
A.① B.③ C.①③ D.②③ E. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质。
②常温下将气体D通入水中发生反应,生成C和E。
③工业上以A、空气和水为原料,通过催化氧化法制成E。
请回答以下问题:
(1)A分子的立体构型是 ;从轨道重叠的方式看,B分子中的共价
键类型有________________________________________________________。
(2)写出②中反应的化学方程式_________________________________。
(3)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,
同时有B生成,写出有关反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
普通玻璃中,Na2SiO3、CaSiO3、SiO2的物质的量之比是Na2SiO3∶CaSiO3∶SiO2=1∶1∶4。
(1)若以aNa2O·bCaO·mSiO2形式表示此玻璃的组成,则a∶b∶m=____________。
(2)若要制备1 000 kg上述玻璃,需要原料各多少千克?共可产生标准状况下的CO2气体多少升?
查看答案和解析>>
科目:高中化学 来源: 题型:
某主族元素R的最高化合价与负化合价代数和为6.下列说法正确的是()
A. R的气态氢化物能燃烧
B. R的最高价氧化物为RO3
C. R一定是第ⅦA族元素
D. R的气态氢化物易溶于水显碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
关于化学键的下列表述中,正确的是()
A. 共价化合物可能含有离子键
B. 离子化合物中可能含有共价键
C. 离子化合物中只含有离子键
D. 硫酸中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、X、Y和Z是原子序数依次递增的短周期元素,其中A与Y同主族,X与Z同主族,A与B和A与X均可形成10个电子化合物,A的单质常温下为密度最小的气体;B与Z的最外层电子数之比为2:3,常见化合物Y2X2是淡黄色固体,能与水反应生成X的单质,其溶液可使酚酞试液变红.请回答下列问题.
(1)Y的原子结构示意图为; Z在周期表中的位置是;B元素的名称为碳.
(2)化合物Y2X2属于A(填序号).
A.离子化合物 B.共价化合物
(3)A与X和A与Z均能形成18个电子的化合物,此两种化合物发生反应生成Z的化学方程式为.
(4)A的单质与X的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入(填物质名称);放电时KOH溶液中的OH﹣往负极方向移动(填正或负).
(5)1980年我国首次制成一辆燃氢汽车,乘员12人,以50km/h行驶了40km.为了有效发展民用氢能源,首先必须制得廉价的氢气.下列可供开发、较经济又具有广阔前景的制氢方法是(填写编号)
①光解海水 ②锌和稀硫酸反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
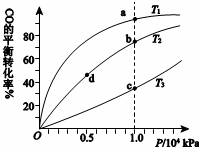
用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)⇌CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与 压强的关系如右下图所示.下列说法正确的是()
压强的关系如右下图所示.下列说法正确的是()
A.温度: T1>T2>T3
B.正反应速率: υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数: K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com