
| A. | H+ | B. | Mg2+ | C. | Cl- | D. | NO3- |
分析 溶液一定呈电中性,则阴阳离子所带总电荷一定相等,硝酸根离子、氯离子都带有1个单位负电荷,由于存在的各离子具有相同的物质的量,若要满足电荷守恒,则两种阳离子也必须带有1个单位正电荷,据此进行解答.
解答 解:H+、Mg2+、K+、NO3-、Cl-中,阴离子NO3-、Cl-都带有1个单位负电荷,且存在的四种离子具有相同的物质的量,根据电荷守恒可知该溶液中存在的两种阳离子一定带有1个单位正电荷,所以阳离子应该为,H+、K+,不可能为Mg2+,
故选B.
点评 本题考查了电荷守恒的应用,题目难度不大,明确电荷守恒的含义为解答关键,试题侧重对学生基础知识的训练和检验,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液中通入CO2气体:SiO32-+H2O+CO2═H2SiO3↓+CO32- | |
| B. | 硫酸铝与氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 氯气与氢氧化钾溶液反应:Cl2+OH-═Cl-+ClO-+2H2O | |
| D. | 小苏打溶液与稀盐酸反应:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用金属钠或者金属钾 | B. | 利用质谱 | ||
| C. | 利用红外光谱法 | D. | 利用核磁共振氢谱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCO3→Na2CO3 | B. | SO2→Na2SO3 | C. | Fe→FeCl2 | D. | CaCO3→Ca(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
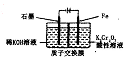 电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )
电解法处理酸性含铬废水(主要含有Cr2O72-)时,以铁板作阴、阳极,处理过程中存在反应Cr2O72-+6Fe2+l4H+═2Cr3++6Fe3++7H2O,最后Cr3+以Cr(OH)3形式除去,下列说法不正确的是( )| A. | 阳极反应为Fe-2e-=Fe2+ | |
| B. | 在阴极室,发生的电极反应为:Cr2O72-+6e-+7H2O=Cr(OH)3+8OH- | |
| C. | 在阳极室,pH增大会有Fe(OH)3沉淀生成 | |
| D. | 电路中每转移12 mol电子,最多有1 mol Cr2O72- 被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.8 mol/LAg+ | B. | 0.4mol/L Ba2+ | C. | 0.4mol/L Mg2+ | D. | 0.2mol/L CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 常温常压下,32gO2和32g O3所含氧原子数分别是2NA和3NA | |
| D. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com