
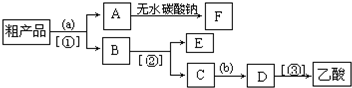
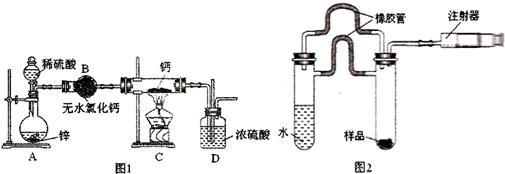
分析 实验室用乙醇、乙酸在浓硫酸作用下,加热发生酯化反应生成乙酸乙酯,反应为可逆反应,可加入过量乙醇以增大乙酸的转化率;
乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与饱和碳酸钠溶液反应,乙醇易溶于水,则用饱和碳酸钠溶液分离混合物,经分液之后可得乙酸钠和乙醇的混合液,蒸馏后可得乙酸钠,加入硫酸后蒸馏可得乙酸,可用无水碳酸钠、硫酸镁等除去乙酸乙酯中的少量水,以此解答该题.
解答 解:(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入碎瓷片,目的是防止暴沸,故答案为:碎瓷片;防止爆沸;
(2)反应中加入过量的乙醇,目的是提高乙酸的转化率,故答案为:提高乙酸的转化率;
(3)合成乙酸乙酯的酯化反应是可逆反应,根据影响平衡移动的因素可知,及时地蒸出生成物,有利于酯化反应向生成酯的方向进行,
故答案为:及时地蒸出生成物,有利于酯化反应向生成酯的方向进行;
(4)由实验流程可知,a为饱和碳酸钠溶液,分离方法I为分液,则油层A为乙酸乙酯,干燥得到A为乙酸乙酯;水层B含乙酸钠、碳酸钠、乙醇,分离方法II为蒸馏,得到E为乙醇,C中含乙酸钠、碳酸钠,试剂b为硫酸,D中含硫酸钠、乙酸,分离方法Ⅲ为蒸馏,
故答案为:饱和碳酸钠溶液;硫酸;分液;蒸馏;蒸馏;
(5)无水碳酸钠能与水反应生成碳酸钠的结晶水合物,可用无水碳酸钠除去乙酸乙酯中的少量水,
故答案为:除去乙酸乙酯中的水份.
点评 本题考查有机物的制备及混合物分离提纯,为高频考点,把握流程中的反应、混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ① | C. | ③④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 醋酸亚铬水合物
醋酸亚铬水合物查看答案和解析>>
科目:高中化学 来源: 题型:解答题
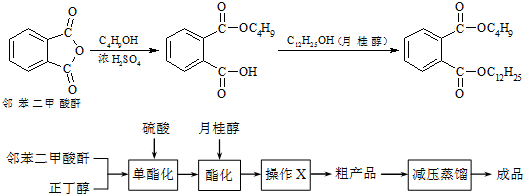
| 化合物 | 溶解性 | 熔点 | 沸点 |
| 邻苯二甲酸酐 | 微溶于冷水、乙醚,易溶于热苯、乙醇、乙酸 | 131.6℃ | 295℃ |
| 正丁醇 | 微溶于水,溶于乙醇、醚、多数有机溶剂 | -88.9℃ | 117.5℃ |
| 月桂醇 | 不溶于水,溶于醇、醚 | 24 | 259℃ |
| 邻苯二甲酸丁基月桂酯 | 不溶于水,溶于多数有机溶剂 | 不祥 | 202~210℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石能源物质内部蕴涵着大量的能量 | |
| B. | 绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 | |
| C. | 吸热反应中由于反应物总能量小于生成物总能量,因而没有利用价值 | |
| D. | 物质的化学能可以在一定条件下转化为热能.电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
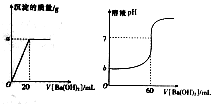 室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)
室温下,某同学为测量硫酸和盐酸混合溶液中溶质的浓度进行如下实验:取混合酸20mL放入锥形瓶中,逐滴滴人0.05mol•L-1的Ba(OH)2溶液,实验记录如下:(1g3=0.5)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
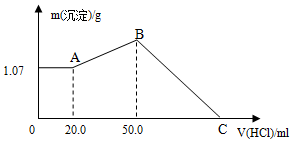 把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:
把NaOH、FeCl3、AlCl3三种固体组成的混合物溶于足量水后,产生1.07g白色沉淀,再向所得悬浊液中逐滴加入1mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.试回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com