
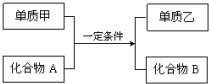
 置换反应的通式可表示为:
置换反应的通式可表示为:分析 单质甲、乙和化合物A、B为中学常见物质,
(1)若单质乙为植物光合作用的产物,则乙应为O2,则甲与化合物A的反应为氟气与水发生置换反应;
(2)若单质甲和化合物B均具有磁性,则甲为Fe,B为Fe3O4,则甲与化合物A的反应为铁与水反应生成四氧化三铁和氢气;
(3)若化合物A是红棕色粉末状固体,则A为Fe2O3,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则B为Al2O3,则该反应为氧化铁发生的铝热反应;
(4)工业上利用置换反应原理制备一种半导体材料,常见反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则B应为氧化镁,乙为碳,所以该反应为Mg和CO2的反应.
解答 解:单质甲、乙和化合物A、B为中学常见物质,
(1)若单质乙为植物光合作用的产物,则乙应为O2,则甲与化合物A的反应为氟气与水发生置换反应,反应的化学方程式为2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(2)若单质甲和化合物B均具有磁性,则甲为Fe,B为Fe3O4,则甲与化合物A的反应为铁与水反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2;
(3)若化合物A是红棕色粉末状固体,则A为Fe2O3,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则B为Al2O3,则该反应为氧化铁发生的铝热反应,反应的化学方程式为2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+2Fe;
(4)工业上利用置换反应原理制备一种半导体材料,常见反应为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常常用作耐高温材料,则B应为氧化镁,乙为碳,所以该反应为Mg和CO2的反应,反应的化学方程式为2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;\;△\;\;}}{\;}$2MgO+C.
点评 本题以置换反应为载体考查了物质的推断,明确物质的性质是解本题关键,物质间的置换反应类型有:金属间的置换反应、非金属间的置换反应、金属和非金属之间的置换反应,难度中等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:推断题
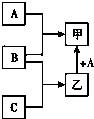 单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).
单质A、B、C与化合物甲、乙之间有如图所示的转化关系(部分产物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
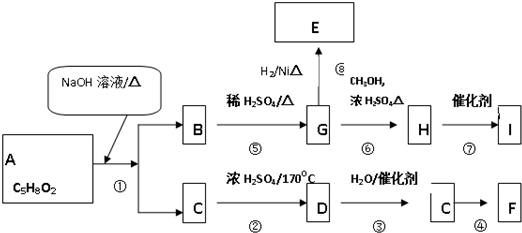
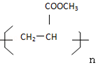
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯和丙三醇 | B. | 乙醇和丙烯 | C. | 甲烷和乙烯 | D. | 苯和丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10 mol•L-1 NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10 mol•L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10 mol•L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10 mol•L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4溶解在过量的稀硝酸中:Fe3O4+8H+═Fe2++2Fe3++4H2O | |
| B. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向AlCl3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 用铜除去CuCl2 溶液中少量的FeCl3:Fe2++Cu═Fe3++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{(b-a)}{V}$ | B. | $\frac{(2b-a)}{V}$ | C. | $\frac{2(b-a)}{V}$ | D. | $\frac{2(2b-a)}{V}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com