
在0.10 mol·L—1CH3COOH溶液中存在如下电离平衡:
CH3COOH  CH3COO— +H+ 对于该平衡,下列叙述正确的是:
CH3COO— +H+ 对于该平衡,下列叙述正确的是:
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.10 mol·L—1HCl溶液,溶液中c(H+)减小
D.加入少量CH3COONa固体,平衡向正反应方向移动
科目:高中化学 来源: 题型:
下列表示化学反应的离子方程式正确的是 ( )
A、硝酸银溶液中加过量的氨水:Ag++NH3·H2O=AgOH↓+NH4+
B、用惰性电极电解MgCl2溶液:2Cl—+2H2O 2OH—+H2↑+Cl2↑
2OH—+H2↑+Cl2↑
C、硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O
D、Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42—+OH—+H+=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为 ( )
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液
A.①③ B.③② C.③① D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下。
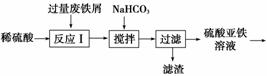

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如表所示。
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的________沉淀,该工艺中“搅拌”的作用是__________。
(2)在实际生产中,反应Ⅱ中常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作________。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为________.
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+可部分水解生成聚合离子Fe2(OH) 。该水解反应的离子方程式为__________________。
。该水解反应的离子方程式为__________________。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO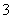 。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母序号)。
。为检验所得产品中是否含有Fe2+,应使用的试剂为________(填字母序号)。
A.氯水 B.KSCN溶液
C.NaOH溶液 D.酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键有关的是:
A.水加热到很高温度都难以分解
B.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
C.水结成冰体积膨胀
D.HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
在以下四种溶液中,各离子一定能大量共存的是:
A.滴加酚酞试液显红色的溶液:Fe3+、NH4+、Cl—、CO32—
B.含溶质为MgCl2的溶液:K+、NO3—、SO42—、Al3+
C.水电离出来的c(H+)=10—13mol/L的溶液:K+、Na+、HCO3—、Br—
D.pH=1的溶液: Fe2+、Na+、I—、NO3—
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,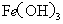
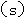 、
、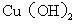 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液
(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是:
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是:
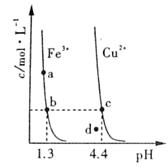 A.
A.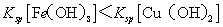
B.加适量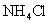 固体可使溶液由
固体可使溶液由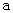 点变到
点变到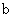 点
点
C.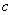
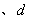 两点代表的溶液中
两点代表的溶液中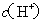 与
与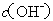 乘积相等
乘积相等
D.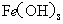 、
、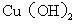 分别在
分别在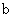 、
、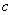 两点代表的溶液中达到饱和
两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中,常温下,Z的单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.简单氢化物的沸点Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在固定体积的密闭容器中发生下列反应:2HI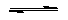 H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为 ( )
H2+I2。若c(HI)由0.1mol·L-1降到0.07mol·L-1时,需要15s,那么c(HI)由0.07mol·L-1降到0.05mol·L-1时,所需反应的时间为 ( )
A. 5s B. 10s C. 大于10s D. 小于10s
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com