
科目:高中化学 来源:2015-2016学年陕西省南校高一下学期期中考试化学试卷(解析版) 题型:选择题
现代科技将  涂于飞机表面,可吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。该原子核内中子数与核外电子数之差的数据正确的是( )
涂于飞机表面,可吸收和屏蔽雷达波和红外线辐射,从而达到隐形目的。该原子核内中子数与核外电子数之差的数据正确的是( )
A.84 B.41 C.125 D.209
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省潍坊市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.Cu→CuO→Cu(OH)2每步转化均能通过一步反应实现
B.铝合金是一种混合物,它比纯铝的熔点高
C.金属铜放置在潮湿的空气中会被锈蚀,生成绿色的铜锈——碱式碳酸铜
D.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市任城区高二下学期期中考试化学试卷(解析版) 题型:选择题
以2-丁烯为原料,通过一步反应(所需其它试剂自选)无法完成的是
A.2-丁醇 B.2,3-二氯丁烷 C.2-溴丁烷 D.2,3-丁二醇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省济宁市任城区高二下学期期中考试化学试卷(解析版) 题型:选择题
下列有机反应中,不属于取代反应的是
A.
B.2CH3CH2OH+O2 2CH3CHO+2H2O
2CH3CHO+2H2O
C.ClCH2CH=CH2+NaOH HOCH2CH=CH2+NaCl
HOCH2CH=CH2+NaCl
D.
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下学期期中考试化学试卷(解析版) 题型:实验题
50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
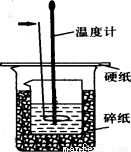
(1)箭头所指仪器的名称是 。作用是 。
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是 。
(3)用相同浓度和体积的醋酸代替HCl溶液进行上述实验,放出的热量会 。(填“偏大”“偏小”或“无影响”)。测得的△H会 (填“偏大”“偏小”或“无影响”)。
(4)上图所示实验装置存在着一处错误,这处错误是 。
(5)实验测得中和热△H = - 57.3 kJ·mol –1若忽略能量的损失,请你计算出实验前后温度的差值△t (保留一位小数,水的比热容c=4.18J/(g·℃)两种溶液的密度近似取1g/ml )
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一下学期期中考试化学试卷(解析版) 题型:选择题
已知反应:① 2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol
下列结论正确的是( )
A.碳的燃烧热为△H = -110.5 kJ/mol
B.1molC(s)所具有的能量一定高于1molCO(g)所具有的能量
C.稀硫酸与稀NaOH溶液反应的中和热为△H = -57.3 kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ 热量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期期中考试化学试卷(解析版) 题型:填空题
黄铁矿被称“愚人金”,化学成分是FeS2,晶体属正方体晶系的硫化物矿物。室温为非活性物质。温度升高后变得活泼。在空气中氧化成三氧化二铁和二氧化硫,主要用于接触法制造硫酸:

回答下列问题:
(1)在FeS2中的S2-的核外电子排布式是________________________;
(2)常温下Fe3+比Fe2+要更加稳定的原因是__________________________________;
(3)将FeS2与稀盐酸反应得到H2S2,H2S2分子中,共价键的类型是___________________;FeS2氧化得到SO2,在SO2分子中的S原子的杂化轨道类型是______________________ ,写出两个与SO2互为等电子体的分子或离子_______________________。-
(4)H2SO4和H2SO3都是S的含氧酸,请用结构知识解释H2SO4比H2SO3酸性强的原因:
_____________________________________________________________________。
(5)FeS2的晶体中的Fe2+离子的排列方式如下图。
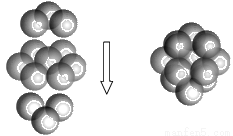
①每个Fe2+周围最近的等距离的S22-离子有____________个。
②已知FeS2的晶胞参数是a0=0.54nm,它的密度为_____________________g·cm-3(列式并计算,阿伏加德罗常数为6.02×1023)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省十三校高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤离子键就是阴、阳离子间的相互引力 ⑥含有离子键的化合物一定是离子化合物 ⑦离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑥⑦ C.①④③ D.②③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com