
分析 (1)依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(2)根据实验操作的步骤计算、量取、稀释、冷却、移液、洗涤、定容、摇匀等操作排序,注意浓硫酸稀释应将浓硫酸加入水中;
(3)依据H2SO4~BaSO4之间关系,结合生成白色沉淀0.48g质量计算硫酸的浓度,分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)用2.4mol/L的H2SO4溶液配制100mL浓度为0.2mol/L的稀H2SO4,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得V×2.4mol/L=100mL×0.2mol/L,解得V=8.3mL;
故答案为:8.3;
(2)配制一定物质的量浓度溶液的一般步骤为:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀,浓硫酸稀释应将浓硫酸加入到水中,所以正确的顺序为:CAFDBEG;
故答案为:CAFDBEG;
(3)则:依据H2SO4 ~BaSO4
1mol 233g
c(H2SO4)×0.01L 0.48g
解得c(H2SO4)≈0.21mol/L,所配溶液浓度偏大;
A.定容时俯视容量瓶,导致溶液体积偏小,溶液浓度偏大,故A选;
B.用量筒取2.4mol/LH2SO4溶液时俯视读数,导致量取的硫酸的体积偏小,硫酸的物质的量偏小,溶液浓度偏小,故B不选;
C.使用容量瓶前未干燥,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故C不选;
D.使用的烧杯和玻璃棒未洗涤彻底,导致部分溶质损失,溶质的物质的量偏小,溶液浓度偏小,故D不选;
E.定容时将蒸馏水洒在容量瓶外面,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故E不选;
故选:A.
点评 本题考查了一定物质的量浓度溶液的配制及误差分析,明确配制原理熟悉配制过程是解题关键,注意容量瓶使用注意事项,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,能使滴有酚酞的NaOH溶液褪色 | |
| B. | Na2O2与水和二氧化碳反应都会生成氧气,可用作供氧剂 | |
| C. | MgO、Al2O3熔点高,可用于耐高温材料 | |
| D. | 常温下,铝与浓硝酸发生钝化,可用铝槽车贮运浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
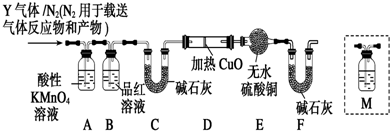
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

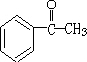 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
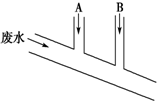 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40和120 | B. | 65和90 | C. | 40和90 | D. | 90和120 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室用石灰石和盐酸反应制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | H2O2溶液中滴加酸性KMnO4溶液:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O | |
| C. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | NaHCO3溶液与足量Ba(OH)2溶液反应:HCO3-+Ba2++OH-═BaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2、H2O | B. | C2H4、CH4 | C. | Cl2、C2H2 | D. | N2H4、H2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )
随着原子序数的递增,五种短周期元素原子半径的相对大小和最高正价或最低负价如图所示.下列说法不正确的是( )| A. | X2W能与WY2反应生成W | |
| B. | 气态氢化物的稳定性:W>Q | |
| C. | Y分别与其它四种元素均可形成至少两种以上化合物 | |
| D. | Y、Z、Q三种元素组成化合物的水溶液可能呈中性,也可能呈碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com