


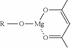
 ,它可发生如下反应:
,它可发生如下反应:
 MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。
MgCl2 +(n+1)NH3↑ + HCl↑ (2分); Mg2++2e-= Mg(2分)。 MgO + CO↑+ CO2↑(2分)
MgO + CO↑+ CO2↑(2分) (2分)。
(2分)。 MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。
MgO + CO↑+ CO2↑;(5)根据信息含有1个羟基,图谱中显示物质中含有2中化学环境的氢且数目相同,即物质中只含有两个氢原子,其它全被氟取代,根据相对分子质量确定为(CF3)2CHOH。

科目:高中化学 来源:不详 题型:单选题
| A.二氧化硫气体与硫化氢气体作用生成硫和水 |
| B.二氧化碳气体与氢氧化钠溶液作用生成碳酸钠和水 |
| C.过氧化钠固体与二氧化碳气体反应生成碳酸钠和氧气 |
| D.Zn粒与稀硫酸反应制取氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.被氧化的元素和被还原的元素的质量之比5:1 |
| B.Cl2既是氧化产物,又是还原产物 |
| C.盐酸既体现酸性,又体现酸性还原性 |
| D.转移5mol电子时,产生67.2L的Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.还原产物为NH4+ |
| B.氧化剂与还原剂的物质的量之比为1∶8 |
| C.若有0.5mol NO3-参加还原反应,则转移电子8mol |
| D.若把该反应设计为电解池,则阳极反应为Fe2+-e→Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.上述焙烧过程的尾气均可直接排空 |
| B.由6 mol CuFeS2生成6 mol Cu,上述共消耗15 mol O2 |
| C.在反应2Cu2O+Cu2S=6Cu+SO2↑中,作氧化剂的只有Cu2O |
| D.电解精炼时,粗铜应与外电源负极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1 mol Cr2O72—得到6 mol电子时,还原产物是Cr3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com