
| A. | 相同体积和相同物质的量浓度的不同溶液里所含溶质的物质的量相同 | |
| B. | 10 mol/L的浓盐酸与H2O等质量混合所得混合液的浓度为5 mol/L | |
| C. | 溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1的溶液的物质的量浓度为$\frac{ρw}{M}$ mol/L | |
| D. | 一定物质的量浓度的溶液配制过程中,仰视定容,所得溶液的浓度偏大 |
分析 A.根据n=cV判断;
B.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍;
C.根据c=$\frac{1000ρω}{M}$计算;
D.定容仰视,液面在刻度线上方,配制溶液体积偏大.
解答 解:A.相同体积和相同物质的量浓度的不同溶液,根据n=cV可知所含溶质的物质的量相同,故A正确;
B.稀盐酸密度小于浓盐酸密度,稀盐酸质量为浓盐酸质量的2倍,则稀盐酸体积大于浓盐酸体积的2倍,故所得混合液的浓度小于5 mol/L,故B错误;
C.溶液中溶质质量分数为w,密度为ρ g•cm-3,溶质摩尔质量为M g•mol-1,根据c=$\frac{1000ρω}{M}$可知,溶液的物质的量浓度为$\frac{1000ρw}{M}$ mol/L,故C错误;
D.定容仰视,液面在刻度线上方,配制溶液体积偏大,所配溶液浓度偏小,故D错误,
故选:A.
点评 本题考查物质的量浓度有关计算、一定物质的量浓度溶液配制误差分析,注意理解掌握物质的量浓度与质量分数关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 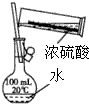 稀释浓硫酸 | |
| B. | 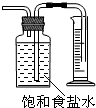 测量Cl2的体积 | |
| C. | 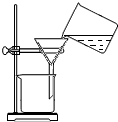 过滤 | |
| D. | 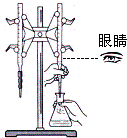 用NaOH标准溶液滴定锥形瓶中的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  表示10 mL 0.01mol•L-1KMnO4酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) | |
| B. | 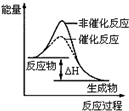 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 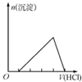 表示示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系 | |
| D. | 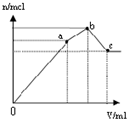 表示向NH4Al(SO4)2溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | 仅②⑤ | C. | 仅②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖均能水解 | |
| B. | 福尔马林、水玻璃、一水合氨均为混合物 | |
| C. | 反应:NH4Cl (s)═NH3(g)+HCl(g)在室温下不能自发进行,说明该反应的△H>0 | |
| D. | C(石墨,s)═C (金刚石,s)△H=+1.9kJ•mol-1,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com