
| A. | 与12C互为同素异形体的14C可用于文物年代的鉴定 | |
| B. | 从海水中提取物质不一定都要通过化学反应实现 | |
| C. | 为避免核泄漏事故的危害,应推广燃煤发电,停建核电站 | |
| D. | 淀粉、油脂、蛋白质等都是天然高分子化合物 |
分析 A.同素异形体是同种元素组成的不同的单质;
B.海水经晒盐可得到粗盐,为物理变化;
C.燃煤发电污染较大;
D.相对分子质量在10000以上的有机化合物为高分子化合物;
解答 解:A.14C可用于文物年代的鉴定,14C与12C互为同位素,同素异形体是单质,故A错误;
B.海水经晒盐可得到粗盐,为物理变化,而从海水中提取溴、碘、镁等物质一定发生化学变化,故B正确;
C.燃煤发电污染较大,核能是清洁能源,故C错误;
D.油脂相对分子质量较小,不是高分子化合物,故D错误;
故选:B.
点评 本题考查了同位素、同素异形体区别,物理变化与化学变化区别,环境污染与治理,高分子化合物判断,熟悉相关概念是解题关键,注意同位素与同素异形体研究对象的不同,题目难度不大.


科目:高中化学 来源: 题型:解答题

 .
.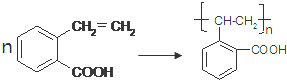 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Cl>I | B. | 碱性:KOH>NaOH | ||
| C. | 酸性:H2SO3>H2SO4 | D. | 结合H+能力:CO32->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
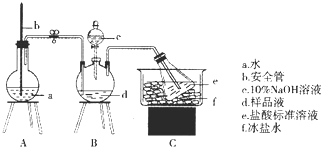
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
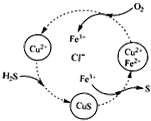 用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )
用含FeCl3、FeCl2、CuCl2的混合溶液和空气可吸收H2S并回收S,且能实现回收液的循环,其物质转化关系如图.下列有关说法错误的是( )| A. | 氢、氯、铜三元素的化合价未发生改变 | |
| B. | 转化过程中包含三步化学反应 | |
| C. | 转化过程中还原剂为H2S和FeCl2 | |
| D. | 总反应可表示为:2H2S+O2→2S+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器中可能有固体残渣 | B. | 所得溶液中存在Fe2+、Fe3+、Cu2+ | ||
| C. | 原固体中n(Fe2O3)>n(Cu) | D. | 再加入铜后,溶液红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性 HCl>H2SO3 | B. | 金属性 Mg>Al | C. | 碱性 NaOH>Mg(OH)2 | D. | 稳定性 HF>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| n(SO32─):n(HSO3─) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
| c(H+)/mol•L─1 | 6.3×10─9 | 6.3×10─8 | 6.3×10─7 |
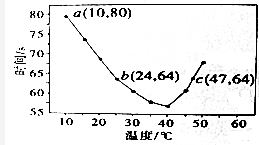
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com