
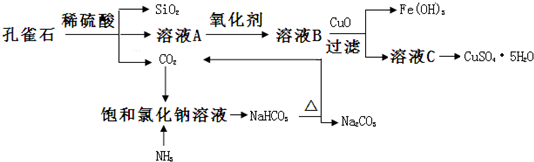
分析 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,加入稀硫酸,得到二氧化硅、二氧化碳以及A溶液,溶液A的金属离子有Cu2+、Fe2+、Fe3+,加入氧化剂将亚铁离子氧化成铁离子,溶液B含有Cu2+、Fe3+,加入CuO,可促进铁离子的水解,生成氢氧化铁沉淀,溶液C为硫酸铜溶液,蒸发、结晶可得到硫酸铜晶体,二氧化碳通入氨饱和的氯化钠溶液,可得到碳酸氢钠,加热分解生成碳酸钠,以此解答该题.
解答 解:(1)加入氧化剂将亚铁离子氧化成铁离子,所加氧化剂不能引入新杂质,可用过氧化氢,可用KSCN检验铁离子,故答案为:c;d;
(2)溶液C获得CuSO4•5H2O,需要经过加热蒸发、冷却结晶、过滤等操作,过滤时用玻璃棒引流浊液,故答案为:冷却结晶;引流;
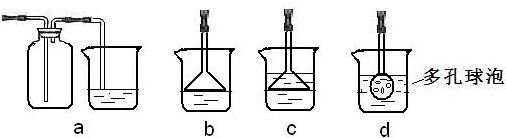
(3)要使氯化钠溶液中生成碳酸氢钠,须在溶液显碱性的条件下通CO2,为使溶液显碱性,可向溶液中加氨水或通NH3;NH3极易溶于水,吸收多余NH3时要防止倒吸,则cd不符合,氨气密度比空气小,则不能用a装置,故答案为:NH3; b;
(4)配制98mL 0.1mol∕LKMnO4标准溶液,需要100mL容量瓶,往该玻璃仪器中加蒸馏水至接近刻度线1cm之后,还要进行的操作是改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相平,防止操作不当,导致体积偏大.
故答案为:100mL容量瓶;改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相平.
点评 本题考查物质制备实验方案的设计,为高频考点,把握制备实验流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,注意除杂不能引入新杂质及防倒吸装置的选择,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 实验室中进行可燃性气体燃烧性质实验时,必须先验纯,后点燃 | |
| B. | 不慎将浓碱沾到皮肤上,应立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸 | |
| D. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
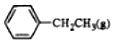 $\stackrel{催化剂}{?}$
$\stackrel{催化剂}{?}$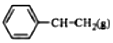 +H2O,己知:
+H2O,己知:| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
| A. | -124 | B. | +124 | C. | +1172 | D. | -1048 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| C. | 2,2-二甲基丙烷与Br2在光照下反应,其一溴取代物只有一种 | |
| D. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
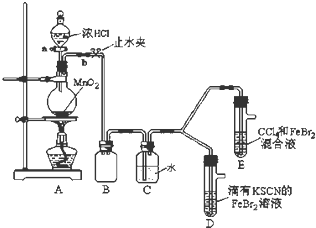
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2>Br2>Fe3+ |
| ⅰ.Fe3++3SCN-?Fe(SCN)3 是一个可逆反应. ⅱ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2. ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应. ⅳ.AgClO、AgBrO均可溶于水. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用催化设施,可以将汽车尾气中CO和NO转化为无害气体 | |
| B. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 | |
| C. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| D. | 防止酸雨发生的重要措施之一是使用清洁能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com