
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装日期 | |
| 分装企业 |
| 1.00×10-3mol/L×0.024L×1mol |
| 2mol |
| 1 |
| 3 |
| 1000g×0.508mg |
| wg |
| 5.08×10-2 |
| w |
| 508 |
| w |
| 5.08×10-2 |
| w |
| 508 |
| w |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
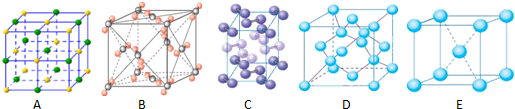
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验内容 | 结论 |
| A | 某气体的水溶液能使红色石蕊试纸变蓝 | 该气体一定是NH3 |
| B | 某气体能使紫色的酸性高锰酸钾溶液褪成无色 | 该气体一定是SO2 |
| C | 某物质的水溶液中加入盐酸产生能使澄清石灰水变浑浊的无色气体 | 该溶液一定含有CO32- |
| D | 某物质的水溶液中加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 该溶液中至少含有SO42-、SO32-中的一种 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应后溶液pH下降 |
| B、通常用盐酸酸化的高锰酸钾溶液 |
| C、方框中粒子为NO2 |
| D、当生成1 mol Mn2+ 需消耗2.5 mol NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若向该溶液中加入足量的NaOH溶液,充分反应后过滤、洗涤、灼烧,最终所得固体质量为72g |
| B、若向该溶液中加入过量的稀H2SO4,产生的气体遇空气能变成红棕色 |
| C、若向该溶液中加入过量的稀H2SO4和KSCN溶液,溶液不显血红色 |
| D、该溶液中所含的离子是:Fe2+、Ba2+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
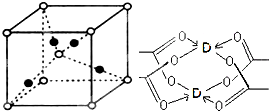
| 电离能 | I, | I2 | I3 | U | I5 | h | I7 |
| (KJ.mol-1) | 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com