
【题目】已知X(g)和Y(g)可以相互转化:2X(g)![]() Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
Y(g) ΔH<0。现将一定量X(g)和Y(g)的混合气体通入一体积为1 L的恒温密闭容器中,反应物及生成物的浓度随时间变化的关系如图所示。则下列说法不正确的是
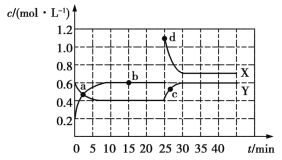
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.a、b、c、d四个点表示的反应体系中,表示化学反应处于平衡状态的只有b点
C.25~30 min内用X表示的平均化学反应速率是0.08 mol·L-1·min-1
D.反应进行至25 min时,曲线发生变化的原因是增加Y的浓度
【答案】D
【解析】
正反应是气体分子数减小的反应,所以当压强不再发生变化时反应达到平衡;各物质的浓度不再发生变化时表示反应处于平衡状态;X表示化学反应的平均速率为X浓度的变化量除以反应时间;曲线发生变化的瞬间可以判断反应条件的改变。
正反应是气体分子数减小的反应,所以当压强不再发生变化时,可以说明反应已经达到平衡状态,A正确;根据图象可知,只有b点表示的反应体系中,各物质的浓度不再发生变化,所以只有b点表示反应处于平衡状态,B正确;25~30 min内X的浓度变化量是0.4 mol·L-1,所以用X表示化学反应的平均速率是![]() =0.08 mol·L-1·min-1,C正确;由图可知,反应进行至25 min时, 曲线发生变化的原因是X物质的浓度增大,D错误。
=0.08 mol·L-1·min-1,C正确;由图可知,反应进行至25 min时, 曲线发生变化的原因是X物质的浓度增大,D错误。
故选D。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】原电池与电解池在生活和生产中有着广泛应用。下列有关判断中正确的是
A.装置甲研究的是电解CuCl2溶液,阳极发生的反应:2Cl-+2e-===Cl2↑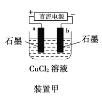
B.装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe-3e-===Fe3+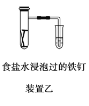
C.装置丙研究的是电解饱和食盐水,B电极发生的反应:2H2O+2e-===H2↑+2OH-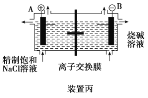
D.向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成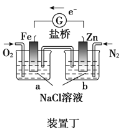
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生产、生活中有极其广泛的用途。
(1)化学式Mg17Al12的合金是一种新型的纳米储氢合金,其储氢原来理为Mg17Al12+17H2=17MgH2+12Al,得到的混合物X(17MgH2+12Al)在一定条件下能释放出H2。
①MgH2中氢元素的化合价为____。
②将X与足量的NaOH溶液混合可得到H2,则766gX充分反应后可得到___molH2。
(2)将铝片放在汞盐溶液中,其表面会形成铝汞合金(铝表面的氧化膜被破坏了),从溶液中取出铝并放置在空气中,铝片表面会迅速长出胡须状的“白毛”(主要成分为Al2O3),同时放出大量的热.导致迅速长出“白毛”的原因可能有:一是铝、汞及介质共同形成了微小原电池,加速了铝的氧化反应;二是___。确定前一种可能原因是否存在的简单方法是___。
(3)无水AlCl3可用作有机合成的催化剂,工业上可用Al2O3、Cl2、焦炭混合反应制备无水AlCl3,该反应的另一种产物是可燃性气体,写出该反应的化学方程式:___。
(4)聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,它是应用广泛的高效净水剂。
①PAFC在强酸性和强碱性溶液中均会失去净水作用,原因是____。
②为检测PAFC中Al和Fe的含量,设计如图所示的流程:
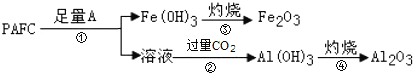
试剂A是____,步骤②中发生反应的离子方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:

 +CH3OH
+CH3OH +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积不变的容器中发生2HI(g)H2(g)+I2(g),下列叙述中可以说明反应2HI(g)H2(g)+I2(g)已达到平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②反应体系的颜色不再变化
③百分组成w(HI)=w(I2)
④反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥v分解(HI)=v生成(HI)
⑦压强不变
A.①③⑤B.②⑥C.④⑤D.④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中进行的可逆反应aA(g)+bB(g)cC(g)在不同温度(T1和T2)及压强(p1和p2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示。下列判断正确的是( )

A.T1<T2,p1<p2,a+b>c,正反应为吸热反应
B.T1>T2,p1<p2,a+b<c,正反应为吸热反应
C.T1<T2,p1>p2,a+b<c,正反应为吸热反应
D.T1>T2,p1>p2,a+b>c,正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 都是元素周期表中前20号主族元素,原子序数依次增大,
都是元素周期表中前20号主族元素,原子序数依次增大,![]() 是地壳中含量最高的元素,
是地壳中含量最高的元素,![]() 、
、![]() 、
、![]() 同周期,
同周期,![]() 和其他元素既不在同一周期也不在同一主族,
和其他元素既不在同一周期也不在同一主族,![]() 的氢化物及其最高价氧化物对应的水化物均为强酸,且
的氢化物及其最高价氧化物对应的水化物均为强酸,且![]() 、
、![]() 、
、![]() 的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
的最高价氧化物对应的水化物两两混合均能发生反应生成盐和水。据此回答下列问题:
(1)![]() 四种元素中,原子半径最大的是______(填元素符号);
四种元素中,原子半径最大的是______(填元素符号);![]() 和
和![]() 的简单氢化物中,沸点较低的是______(填化学式)。
的简单氢化物中,沸点较低的是______(填化学式)。
(2)元素![]() 在元素周期表中的位置是______,
在元素周期表中的位置是______,![]() 、
、![]() 的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
的最高价氧化物对应的水化物之间发生反应的化学方程式为____________________________________________________________。
(3)![]() 、
、![]() 、
、![]() 可以形成多种盐,其中一种盐中
可以形成多种盐,其中一种盐中![]() 、
、![]() 、
、![]() 三种元素的原子个数比为
三种元素的原子个数比为![]() ,该盐的化学名称为______。它的水溶液与
,该盐的化学名称为______。它的水溶液与![]() 的氢化物的水溶液反应可生成
的氢化物的水溶液反应可生成![]() 的单质,该反应的离子方程式______________________________,反应生成
的单质,该反应的离子方程式______________________________,反应生成![]() 的单质时,转移电子______
的单质时,转移电子______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列反应合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。在体积为2L的密闭容器中,充入2molCO2和9molH2,测得CO2(g)和CH3OH(g)浓度随时间变化如图所示:
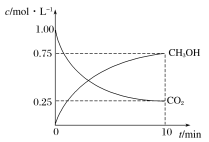
(1)该反应的平衡常数K表达式为________。
(2)0~10min时间内,该反应的平均反应速率v(H2O)=_______,H2的转化率为_______。
(3)下列叙述中,能说明反应已达到化学平衡状态的是________(填字母)。
A.容器内CO2、H2、CH3OH、H2O(g)的浓度之比为1∶3∶1∶1
B.v正(CO2)∶v逆(H2)=1∶3
C.平衡常数K保持不变
D.混合气体的平均相对分子质量保持不变
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH1=-1452.8kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z是金属元素;V元素的一种核素原子核内无中子,Z元素原子的最外层只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子L层电子数是K层电子数的3倍;X元素原子的最外层电子数是Y元素原子最外层电子数的一半。回答下列问题:
(1)V的一种核素中质子数为中子数的1/2,则该核素的名称为_______,是制造_______的原料。
(2)W元素的原子结构示意图为________。
(3)X元素的离子结构示意图为________。
(4)Y的单质在加热条件下与铁反应的化学方程式为______。
(5)Z的元素符号为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com