
 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
分析 Ⅰ.(1)①根据溶液的酸碱性选择滴定管;
②根据中和滴定原理计算盐酸的浓度;
(2)酚酞在盐酸中为无色,滴定终点变为浅红色;
(3)根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$分析不当操作对V(标准)×的影响,以此判断浓度的误差;
Ⅱ.(1)反应过程中用含Fe3+的溶液作指示剂,发生络合反应;
(2)因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高.
解答 解:Ⅰ.(1)①应用酸式滴定管盛装盐酸,故答案为:甲;
②根据表格,平均消耗V(NaOH)=$\frac{23.00+23.10+22.90}{3}$mL=23.00mL,
HCl+NaOH=NaCl+H2O
c(HCl)×20.00mL 0.80mol/L×23.00mL
c(HCl)=$\frac{0.80mol/L×23.00mL}{20.00mL}$=0.92mol•L-1;
故答案为:0.92 mol•L-1;
(2)酚酞在盐酸中为无色,滴定终点变为浅红色,且30s内颜色不变,故答案为:无色变浅红色且30 s不变色;
(3)A.盛装待测液的锥形瓶用水洗后未干燥,不会产生误差,故A错误;
B.碱式滴定管在滴定前有气泡,滴定后气泡消失,造成V(标准)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$可知,测定c(HCl)偏高,故C正确;
C.碱式滴定管用蒸馏水洗净后,未用标准氢氧化钠溶液润洗,测定V(HCl)偏大,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$可知,测定c(HCl)偏高,故B正确;
D.读碱式滴定管的刻度时,滴定前仰视凹液面最低处,滴定后俯视读数,造成V(标准)偏小,根据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$可知,测定c(HCl)偏低,故D错误,
故答案为:B C;
Ⅱ.(1)反应过程中用含Fe3+的溶液作指示剂,发生络合反应,反应的离子方程式为Fe3++3SCN-?Fe(SCN)3,故答案为:Fe3++3SCN-?Fe(SCN)3;
(2)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,因为硝酸银的总量一定,若两种沉淀表面吸附部分Ag+,导致测得过量的Ag+偏少,则与Cl-反应的Ag+的量会偏高,
故答案为:偏高.
点评 本题主要考查物质含量的测定,为高频考点,侧重于学生的分析能力和计算能力的考查,题目涉及中和滴定操作、误差分析以及计算,物质组成的实验设计方案,滴定实验的数据计算应用,注意沉淀溶解平衡的分析判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
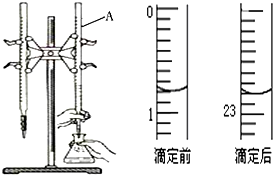 图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锥形瓶用蒸馏水洗涤后,直接盛盐酸溶液 | |
| B. | 中和滴定将要达到滴定终点时,眼睛注视滴定管中液面的位置变化 | |
| C. | 滴定管装碱液前未用标准碱液润洗 | |
| D. | 滴定时,锥形瓶摇动太剧烈,有少量溶液溅出 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 盐酸的体积(mL) | 标准NaOH溶液的体积(mL) |
| 1 | 20.00 | 18.20 |
| 2 | 17.10 | |
| 3 | 16.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日期间,在任意场所燃放烟花爆竹 | |
| B. | 实验时,将水倒入浓硫酸配置稀硫酸 | |
| C. | 煤矿矿井,必须通风,严禁烟火 | |
| D. | 用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com