
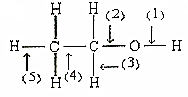 根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.
根据如图所示的乙醇分子结构判定在以下反应中分子中化学键的断裂情况.分析 金属钠与乙醇反应取代羟基上氢原子,断开的羟基上的氢氧键;乙醇在铜作催化剂与氧气反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;发生消去反应时,反应条件是浓硫酸、温度170℃,以此解答.
解答 解:(1)乙醇与与金属钠反应生成乙醇钠和氢气,断开的羟基上的氢氧键,即①断裂,故答案为:①;
(2)乙醇和浓硫酸共热到170℃时发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键,即②⑤断裂,故答案为:②⑤;
(3)乙醇在铜或银催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即①③断裂,故答案为:①③;
(4)铜和氧气反应生成氧化铜,为黑色固体,发生2Cu+02$\frac{\underline{\;\;△\;\;}}{\;}$2Cu0,加热条件下,乙醇和氧化铜反应生成铜和乙醛,反应的方程式为CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+Cu+H20,
故答案为:黑;红;2Cu+02$\frac{\underline{\;\;△\;\;}}{\;}$2Cu0;CuO+CH3CH2OH$\stackrel{△}{→}$CH3CHO+Cu+H20;
点评 本题考查有机物的结构和性质,侧重于学生的分析能力的考查,注意把握有机物的官能团的性质和结构特点,学习中注意乙醇的性质,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | 灼热的炭与CO2反应 | D. | 氢氧化钠溶液与醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是两种单质的混合物 | B. | 是共价化合物 | ||
| C. | 该新物质硬度很大 | D. | 含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知:pAg=-lg{c(Ag+)},Ksp(AgCl)=1×10-12.如图该温度下是向10mL AgNO3溶液中逐渐加入0.1mol•L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论不正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | 图中x点的坐标为(100,6) | |
| C. | 若升高温度,图象会发生变化 | |
| D. | 把0.1mol•L-1的NaCl换成0.1mol•L-1 NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子里含有-C≡C-的不饱和链烃 | |
| B. | 既能使溴水褪色,又能使酸性KMnO4溶液褪色,但原理不同 | |
| C. | 分子里所有的碳原子都在一条直线上 | |
| D. | 碳原子数相同的炔烃和二烯烃是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | B. | H2O2的电子式: | ||
| C. | 硫原子的结构示意图: | D. | 甲烷分子的比例模型: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com